俗话说“卤水点豆腐,一物降一物”,这其实说的就是胶体的聚沉。向胶体中 加入酸、碱、盐,能使胶粒所带电荷被中和,从而“聚集长大”直至生成沉淀。使一定量的胶体溶液在规定时间内开始凝聚所需酸、碱、盐等的浓度(mmol/L)称做“聚沉值”。电解质的聚沉值越小,表示其凝聚能力越大。实验证明,凝聚主要取决于胶粒带相反电荷的离子所带的电荷数,电荷数越大,凝聚能力越大,则向Fe(OH)3胶体中加入下列电解质时,其“聚沉值”最小的为(注:Fe(OH)3胶粒带正电荷)( )
加入酸、碱、盐,能使胶粒所带电荷被中和,从而“聚集长大”直至生成沉淀。使一定量的胶体溶液在规定时间内开始凝聚所需酸、碱、盐等的浓度(mmol/L)称做“聚沉值”。电解质的聚沉值越小,表示其凝聚能力越大。实验证明,凝聚主要取决于胶粒带相反电荷的离子所带的电荷数,电荷数越大,凝聚能力越大,则向Fe(OH)3胶体中加入下列电解质时,其“聚沉值”最小的为(注:Fe(OH)3胶粒带正电荷)( )
| A.NaOH | B.AgNO3 | C.BaCl2 | D.Na3PO4 |
下面有关晶体的叙述中,错误的是
| A.金刚石网状结构中,碳原子和共价键的个数比为1:2 |
| B.氯化钠晶体中,每个Na+周围紧邻且等距离的Cl-构成的空间结构为立方体 |
| C.氯化铯晶体中,每个Cs+周围紧邻6个Cs+ |
| D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子 |
下列有关作用力的说法正确的是
| A.金属键、离子键、分子间作用力都没有方向性和饱和性 |
| B.键能、金属的原子化热、晶格能分别可以衡量氢键、金属键、离子键的强弱 |
| C.离子键、金属键、氢键、范德华力本质上都是静电作用 |
| D.乙酸、丙醇、丙酮的沸点都比丁烷高是因为前三者分子间都存在氢键 |
下列说法正确的是
| A.第一电离能越小的元素其单质金属活泼性一定越大 |
| B.电负性越小的元素金属性一定越强 |
| C.元素电负性相差小于1.7的元素之间形成的化学键一定为共价键 |
| D.制造光电材料的元素主要从IA族中寻找其主要原因是IA的第一电离能比较低 |
下列说法不正确的是
A.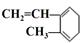 与Br2发生1:1加成反应的产物有5种 与Br2发生1:1加成反应的产物有5种 |
B.除去苯中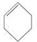 的方法:加溴水,充分振荡,静置分液。 的方法:加溴水,充分振荡,静置分液。 |
C.1mol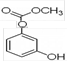 最多能与4mol氢氧化钠反应。 最多能与4mol氢氧化钠反应。 |
| D.采用分子筛固体酸作为苯和丙烯反应的催化剂来制备异丙苯,符合绿色化学工艺。 |
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是
| A.第一电离能:③>②>① | B.原子半径:③>②>① |
| C.电负性:③>②>① | D.最高正化合价:③>②>① |