(7分)有A、B、C、D四种无色溶液。它们的溶质分别是Na2CO3、Na2SO4、NaHSO4、BaCl2中的一种,为了确定各是何种溶液进行了下列实验,记录为:①A+D―→溶液+气体,②B+C―→溶液+沉淀,③B+A―→溶液+沉淀X,④D+B―→溶液Y+沉淀,⑤溶液Y+沉淀X―→溶液+气体。
(1)根据以上记录确定:A________、B________、C________、D________
(填化学式)。
(2)写出①、③、⑤各反应的离子方程式:
①____________________________________________________;
③___ _________________________________________________;
_________________________________________________;
⑤____________________________________________________。
在室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可按下面框图进行反应。又知E溶液是无色的,请回 答:
答: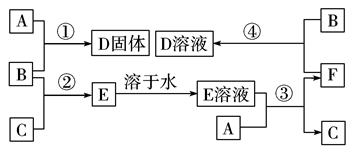
(1)写出下列物质的化学式:
A____________,B____________,C____________。
(2)反应①的化学方程式为: 。
(3)反应③的化学方程式为: 。
(4)反应④的离子方程式为: 。
已知X、Y、Z、W是短周期中的四种非金属元素,它们的原子序数依次增大,X元素的原子形成的阳离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子 数的2倍。
数的2倍。 试回答:
试回答:
(1) 写出下列元素的元素符号:X_________、Y_________、Z_________、 W_________。
W_________。
(2 这四种元素可组成原子个数比为5∶1∶1∶3的化合物(按X、Y、Z、W的顺序),该化合物的水溶液与足量NaOH溶液反应的离子方程式为。
(3) 将9g单质Y在足量W单质中燃烧,所得气体通入1L 1mol·L-1 NaOH溶液中,完全吸收后,将溶液在减压低温条件下蒸干,得到不含结晶水的固体质量为g。
A、B、C、D四种短周期元素,0.5molA的元素的离子得到NA个电子后被还原为中性原子;0.4gA的氧化物恰好与100mL0.2mol/L的盐酸完全反应;A元素原子核内质子数与中子数相等。B元素原子核外电子数比A元素原子核外电子数多1;Cˉ离子核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层电子数的2倍。请填写下列空格:
(1)推断A、B、C、D四种元素的符号A_________;B_________;C________;D________;
(2)D元素的最高价氧化物的电子式是_______________结构式该分子内含有_______键(填极性或非极性)。
随着科学技术的发展,阿佛加德罗常数的测定手段越来越多,测定的精度也越来越高。现有一种简单可行的测定方法,具体步骤为: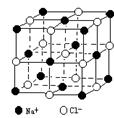
①将NaCl固体研细、干燥后,准确称取m g NaCl固体并转移到定容仪器A中。
②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度,计算出NaCl固体的体积为V cm3。
(1)步骤①中仪器A最好使用(填序号)。
| A.量筒 | B.烧杯 | C.容量瓶 | D.试管 |
(2)步骤②中是用滴定管,能否用水代替苯,理由是 。
。
(3)已知NaCl晶体中,靠得最近的Na+、Cl—间的距离为a cm(如上图),则用上述方法测得的阿佛加德常数NA的表达式为。
过渡金属元素氧化物的应用研究是目前科学研究的前沿之一,试回答下列问题:
Ⅰ、二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化。有关甲醛、苯、二氧化碳及水说法正确的是。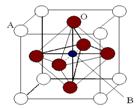
A.苯与B3N3H6互为等电子体
B.甲醛、苯分子中碳原子均采用sp2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲醛高得多,是因为水分子间能形 成氢键
成氢键
Ⅱ、2007年诺贝尔物理学奖为法国科学家阿尔贝·费尔和德国科学家彼得·格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就。某钙钛型复合氧化物(如右图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应。
⑴用A、B、O表示这类特殊晶体的化学式:。
⑵已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3, (x < 0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁转变及金属-半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为:。(用含x的代数式表示)
、⑶Mn的外围电子轨道表示式为:。
⑷下列有关说法正确的是。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.铬的堆积方式与钾相同,则其堆积方式如右图:
D.锰的电负性为1.59 ,Cr的电负性为1.66,说明锰的金属性比铬强