过氧化氢H2O2(氧的化合价为-1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
| A.Na2O2 +2HCl= 2NaCl+H2O2 |
| B.Ag2O+ H2O2=2Ag+O2+ H2O |
| C.2 H2O2="2" H2O+O2 |
| D.3 H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8 H2O |
(1)H2O2仅体现氧化性的反应是(填代号) 。
(2)H2O2既体现氧化性又体现还原性的反应是(填代号) 。
(3)B反应式中的氧化产物是 。
(4)上述反应说明H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是: 。
钢铁是21世纪用途最广的结构材料和功能材料。其成分主要是Fe和少量C。
(1)工业上在炼铁高炉中用CO热还原Fe2O3冶炼铁。写出该反应的化学方程式并用单线桥表示电子转移的方向和数目。
(2)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图(黑球代表Fe,白球代表Mg)。则铁镁合金的化学式为。
(3)Fe3+的电子排布式为;CH3+微粒的中心原子杂化轨道类型为;
(4)向一定量的FeCl3溶液中加入适量KSCN溶液,溶液变红色。该反应体系中存在化学平衡(用反应式表示);向上述红色溶液中加入Mg(OH)2固体,可观察到溶液红色变浅,有红褐色沉淀析出。试用平衡移动原理解释该现象。(不考虑SCN—与Mg2+反应)
室安卡因(G)是一种抗心律失常药物,可由下列路线合成: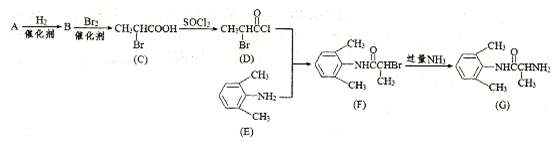
(1)已知A是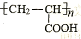 的单体,则A中所含官能团的名称是。
的单体,则A中所含官能团的名称是。
(2)F→G的反应类型是。
(3)下列关于室安卡因(G)说法不正确的是(填字母编号)。
a.属于氨基酸 b.能发生加成反应
c.能使酸性高锰酸钾溶液退色 d.其苯环上的一氯代物只有两种
(4)H是C的同系物,其核磁共振氢谱图中有两个峰,它的相对分子质量为167,则H的结构简式为。
(5)写出C与足量NaOH醇溶液共热时反应的化学方程式:
。
氨化铁是常见的水处理剂,无水晶 易升华。工业上制备无水的
易升华。工业上制备无水的 的一种工艺如图所示:
的一种工艺如图所示: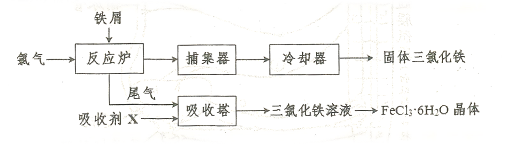
(1)加入吸收塔的吸收剂X应是(填字母编号)。
a.NaOH溶液 b.饱和食盐水 c.FeCl2溶液 d.淀粉KI溶液
(2)取0.5mL饱和FeCl3溶液滴入50mL沸水中,得红褐色氢氧化铁胶体,则发生反应的离子方程式为,胶体粒子的直径一般不超过。
(3)实验室中从FeCl3溶液制得FeCl3·6H2O晶体的过程中,需先加入且保持过量,然后进行的操作依次为、冷却结晶、过滤。
(4)将H2S气体通入FeCl3溶液中会出现浑浊,则其反应的离子方程式为。
(5)铁铬氯化还原液流电池是一种低成本的储能电池,电池结构如图所示(电极材料为石墨),工作原理为:Fe3++Cr2+ Fe2++Cr3+,则电池放电时,Cl-将移向极(填“正”或“负”);充电时,阴极的电极反应式为。
Fe2++Cr3+,则电池放电时,Cl-将移向极(填“正”或“负”);充电时,阴极的电极反应式为。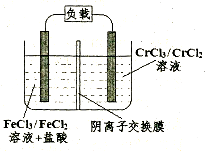
CO、NO、NO2、SO2等都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题。
(1)上述四种气体直接排入空气中会引起酸雨的有。
(2)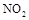 可用尿素
可用尿素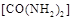 还原(尿素中C元素的化合价为+4价),反应的方程式为:
还原(尿素中C元素的化合价为+4价),反应的方程式为: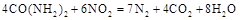 。当消耗掉12g尿素时,转移电子的物质的量是。
。当消耗掉12g尿素时,转移电子的物质的量是。
(3)SNCR-SCR是一种新型的烟气脱硝技术(除去烟气中的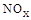 ),改流程中发生的主要反应有:
),改流程中发生的主要反应有: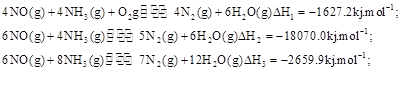
则反应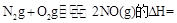 KJ/mol
KJ/mol
(4)CO可用于合成甲醇,反应方程式为 。在一容积可变的密闭容器中充有10mol CO和20molH2,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(a)与温度(T)、压强(P)的关系如图所示。
。在一容积可变的密闭容器中充有10mol CO和20molH2,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(a)与温度(T)、压强(P)的关系如图所示。
则该反应是 0(填“>”或“<”)。若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为L。
0(填“>”或“<”)。若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为L。
(5)工业上用氨水将来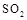 转化成都(NH4)2SO3,再氧化成(NH4)2SO4,(NH4)2SO4溶液中离子浓度大小顺序为;已知25℃时,0.05mol/L(NH4)2SO4溶液的
转化成都(NH4)2SO3,再氧化成(NH4)2SO4,(NH4)2SO4溶液中离子浓度大小顺序为;已知25℃时,0.05mol/L(NH4)2SO4溶液的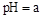 ,则
,则 =(用含a的代数式表示,已知
=(用含a的代数式表示,已知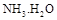 的电离常数
的电离常数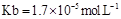 )。
)。
传统中药的砷剂俗称“砒霜”,请回答下列问题:
(1)砷剂的分子结构如图所示。该化合物中As原子的杂化方式为______。
(2)基态砷原子的价层电子排布式为___________________,砷与硒的第一电离能较大的是__________。
(3)已知: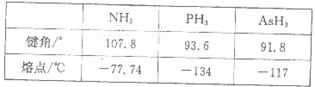
依据表中数据解释NH3熔点最高的原因____________________。
(4)砷酸(H3AsO4)是一种三元中强酸,根据价层电子对互斥理论推测AsO43-的空间构型为____________________。
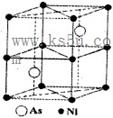
(5)砷镍合金的晶胞如图所示,该晶体中与每个Ni原子距离最近的As原子有______个。