某原电池总反应的离子方程式: 2Fe3+ + Fe=3Fe2+,不能实现该原理反应的原电池是
| A.正极为Cu,负极为Fe,电解质溶液为FeCl3溶液 |
| B.正极为C,负极为Fe,电解质溶液为Fe(NO3)3溶液 |
| C.正极为Fe, 负极为Zn,电解质溶液为Fe2(SO4)3溶液 |
| D.正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3溶液 |
在恒温恒容的密闭容器中,对于可逆反应A(g)+B(g)  2C(g),可以判断达到化学平衡状态的是
2C(g),可以判断达到化学平衡状态的是
| A.体系压强不变 | B.单位时间消耗n molA,同时生成2nmolC |
| C.A的转化率不变 | D.容器内气体密度不变 |
把下列四种 X 溶液分别加入四个盛有 10mL2 mol•L-1盐酸的烧杯中,均匀加水稀释到50mL。此时X 和盐酸缓缓地进行反应。其中反应速率最大的是
| A.20mL 3 mol•L-1的 X 溶液 | B.20mL 2 mol•L-1的 X 溶液 |
C. 10mL 4 mol•L-1的 X 溶液 10mL 4 mol•L-1的 X 溶液 |
D.l0mL 2 mol•L-1的 X 溶液 |
在一定温度下,容器内某一反应中M、N的物质的量随反应时间的变化曲线如图,下列表述中正确的是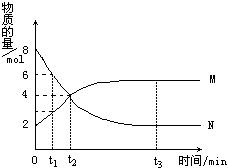
A.反应的化学方程式为:2M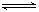 N N |
B.t2时,正逆反应速率相等,达到平衡 |
| C.t3时,正反应速率大于逆反应速率 | D.t1时,N的浓度是M浓度的2倍 |
下图是关于反应A2(g)+3B2(g)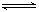 2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是
2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是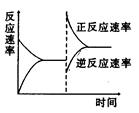
| A.升高温度,同时加压 |
| B.降低温度,同时减压 |
| C.增大反应物浓度,同时减小生成物浓度 |
| D.增大反应物浓度,同时使用催化剂 |
在2L密闭容器中,发生3A(气)+B(气) ==2C(气)的反应,若最初加入A和B都是4mol,A的平均反应速率为0.12mol/(L·s),则10秒钟后容器中B的物质的量为
| A.2.8mol | B.1.6mol | C.3.2mol | D.3.6mol |