(1)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO)∶CO(g)+2H2(g) CH3OH(g).
CH3OH(g).
根据题意和所给图象完成下列各题:
①反应达到平衡时,平衡常数表达 式K= ,
式K= ,
②升高 温度,K值 (填“增大”“减小”或“不变”)
温度,K值 (填“增大”“减小”或“不变”)
(2)一定温度下,将3 mol A气体和1 mol B气体通入一密闭容器中,发生如下反应:3A(g) + B(g)  xC(g) 请填写下列空白:若容器体积固定为2 L,反应2 min时测得剩余0.6 mol B,C的浓度为0.4 mol/L。
xC(g) 请填写下列空白:若容器体积固定为2 L,反应2 min时测得剩余0.6 mol B,C的浓度为0.4 mol/L。
①x=
②若反应经4 min达到平衡,平衡时C的浓度________ 0.8 mol/L(填“大于”、“等 于”或“小于”)。
③平衡混合物中,C的体积分数为22%,则B的转化率是______________。
(3)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
①合成氨反应N2 (g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移 动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
②有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl—NH4Cl为电解质溶液制造新型燃烧电池,放电过程中,溶液中铵根离子浓度逐渐增大。请写出该电池的正极反应式  。
。
有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大,已知A和B 原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C在空气中燃烧时呈现黄色火焰, C的单质在高温下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答:
(1)元素名称: A ______ B _____ C _____ D ______。
(2)D元素位于周期表中周期族。
(3)写出AB2与C2B2反应的化学方程式。
(4)画出B的原子结构简图 ___________________。
(5)电子式表示化合物 C2D:。
用“大于”或“小于”或“等于”回答下列问题:
(1)酸性:H2CO3H2SiO3, H2SiO3H3PO4
(2)碱性:Ca(OH)2Mg(OH)2, Mg(OH)2Al(OH)3
(3)气态氢化物稳定性:H2OH2S, H2SHCl
(4)还原性: H2OH2S, H2SHCl
(5)酸性: H2SO4H2SO3, HClO4HClO
从以上答案中可以归纳出:
①元素的非金属性越强,其对应最高价氧化物水化物的酸性越;
②元素的金属性越强,其对应最高价氧化物水化物的碱性越。
、4g甲烷在氧气中燃烧生成二氧化碳和液态水,放出222.5KJ热量,写出甲烷燃烧的热化学方程式
有下列各组微粒或物质:
A、O2和O3B、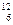 C和
C和 C C、CH3CH2CH2CH3和
C C、CH3CH2CH2CH3和
(1)组两种微粒互为同位素;
(2)组两种物质互为同素异形体;
(3)组两物质互为同分异构体;
(4)组两物质是同一物质。
下列反应中,属于放热反应的是,属于吸热反应的是
①食物在空气中腐败②生石灰与水作用制熟石灰③碳和二氧化碳化合生成CO ④酸与碱中和反应⑤加热KClO3和MnO2的混合物制O2⑥将氯化铵晶体和氢氧化钡晶体混合均匀放在日光下暴晒