在生活中根据不同的分类标准可以将分散系分为各种类型,例如根据分散质 不同可将分散系分为溶液、胶体和浊液,其中分散质微粒的直径在 之间的分散系叫做胶体,胶体有很强的吸附能力,在日常生活中通常作为 剂。
某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-等,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加人铜片和稀硫酸共热,产生无色气体,该气体遇到空气立即变为红棕色;
③取溶液少许,加人氨水有白色沉淀生成,继续加人过量氨水,沉淀不消失;
④取溶液少许,滴人氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴人硝酸银溶液产生白色沉淀,再加人过量的稀硝酸,沉淀不消失。
请回答下列问题:
(1)在实验①中,下图所示的操作中正确的是___________(填代号)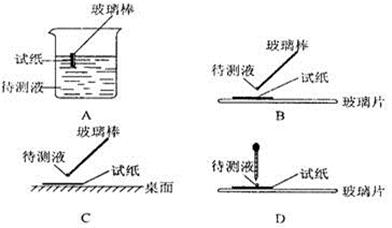
(2)根据上述实验判断原溶液中肯定存在的离子是______________________,肯定不存在的离子是______________________。
(3)写出与②实验有关的离子方程式:
_____________________________________________________________
I.(8分)A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有5个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A的最高价氧化物的水化物是___________(填化学式);
(2)物质E中所包含的化学键有______________,写出C、D两元素形成的化合物C2D的电子式______________________;
(3)把盛有48 mL AB、AB2混合气体的容器倒置于水中(同温、同压下),待液面稳定后,容器内气体体积变为24 mL,则原混合气体中AB的体积分数为__________。
II.(6分)下表为长式周期表的一部分,其中的编号代表对应的元素。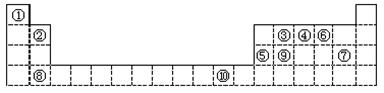
请回答下列问题:
(1)写出元素⑩的基态原子的电子排布式_________________。
(2)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的成对电子数为_____
(3)③④⑤三种元素的第一电离能由大到小的顺序是(填序号)___________。
某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为:
(2)A与溴的四氯化碳溶液反应的化学方程式为;反应类型是;
(3)已知: 。请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式;(仿照信息写出关系式即可)
。请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式;(仿照信息写出关系式即可)
(4)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式;
(5)在一定条件下,由A聚合得到的高分子化合物的结构简式为。
用于2008年奥运会的国家游泳中心(水立方)的建筑采用了膜材料ETFE,它是乙烯—四氟乙烯的共聚物,具有许多优异的性能:
①具有特有的表面抗粘着的性能;
②使用寿命至少为25 ~ 35年,是用于永久性多层可移动屋顶结构的理想材料;
③达到B1、DIN4102防火等级标准,且不会自燃;
④质量很轻,只有同等大小的玻璃质量的1 %;
⑤韧性好、抗拉强度高、不易被撕裂,延展性大于400 %;
⑥能有效地利用自然光,透光率可高达95 %,同时起到保温隔热的性能,节省能源。(1)②说明ETFE的化学性质在自然条件下较__________ (填“稳定”或“活泼”);
(2)上述特点中,属于ETFE的物理性质的有________。(全对2分,有错、少选不给分)
已知某有机物的结构简式为:
(1)该有机物中含氧官能团的名称是___________。
(2)该有机物发生加成聚合反应后,所得产物的结构简式为______________。
(3)写出该有机物发生消去反应的化学方程式(注明反应条件):。
(4)能与新制氢氧化铜反应的同分异构体有种