( 12分)Ⅰ.(1)在一密闭的2L的容器里充入8mol SO2和4mol 18O2,在一定条件下开始反应:2SO2(g)+O2(g)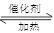 2SO3(g)2min末测得容器中有7.2mol SO2。试回答:
2SO3(g)2min末测得容器中有7.2mol SO2。试回答:
①反应后18O原子存在于哪些物质中 ;
② 2min末SO3的浓度________________________;
③用O2的浓度变化表示该时间段内的化学反应速率_______________________。
Ⅱ.某化学反应2A (g) B(g)+D(g)在3种不同条件下进行,B和D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g)在3种不同条件下进行,B和D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
| 实验序号 |
 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
| 1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
800℃ |
C2 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 3 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1) 实验1达到平衡的时间是__________min,C2_____1.0 min·L-1(填“<”“>”或“=”)。
(2)实验3比实验1的反应速率_________(填“快”或“慢”),原因是___________________________________________________________________________。
(3) 如果2A (g) B(g)+D(g)是一个吸热反应,那么实验3与实验1相比,在相同体积时___________吸收的热量多,理由是___________________________________________。
炭火炉内的炭燃烧至炽热时,在往炉膛底的热炭上喷洒少量水的瞬间,炉火更旺,这是因为。
如果烧去“同量的炭,喷洒过水和没有洒过水的炭火炉相比,放出的总能量(填“相同”或“不相同”),原因是 。
已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出14种元素的X的数值:
| 元素 |
H |
Li |
Be |
B |
C |
O |
F |
| X的数值 |
2.20 |
0.98 |
1.57 |
2.04 |
2.55 |
3.44 |
3.98 |
| 元素 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
| X的数值 |
0.93 |
1.31 |
1.61 |
1.90 |
2.19 |
2.58 |
3.16 |
试结合元素周期律知识完成下列问题:
(1)根据上表给出的数据,简述主族元素的X的数值大小与元素的金属性或非金属性强弱之间的关系___________________________;
(2)简述第二周期元素(除惰性气体外)的X的数值大小与原子半径之间的关系___________________________________。
(3)某化合物分子中含有S—N键,你认为该共用电子对偏向于_____原子(填元素符号)。
(4)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的化学键一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中的化学键类型是______________。
(5)上表中元素形成的AB型化合物中,离子性最强的是________。
由A、B元素组成的含4个原子核共42个电子的负二价阴离子中,每1个A的核内质子数比B的核内质子数多8个,试通过计算确定:
(1)A、B元素名称分别为____________和___________。
(2)写出该阴离子的离子符号________________。
(3)该阴离子与钠离子形成的化合物中含有__________键。
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: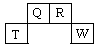
(1)T的原子结构示意图为 。
(2)元素的非金属性为(原子的得电子能力):Q W(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为 。
(4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是 。
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是 。
将20g Ba(OH)2·8H2O晶体与10 g NH4Cl晶体一起放入小烧杯中,将烧杯放在滴有3~4滴水的玻璃片上,用玻璃棒迅速搅拌。
(1)实验中玻璃棒的作用是。
(2)写出有关反应的化学方程式。
(3)实验中观察到的现象有、和反应混合物成糊状。
(4)通过现象,说明该反应为(填“吸热”或“放热”)反应,这是由于反应物的总能量(填“小于”或“大于”)生成物的总能量。