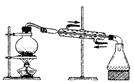
实验是化学研究的基础,关于下列各实验装置图的叙述中,错误的是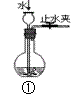
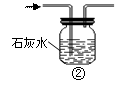

③
| A.装置①当止水夹关闭,而后从长颈漏斗注水操作可用于检查该装置的气密性 |
| B.装置②可用于除去CO中混有的少量CO2 |
| C.装置③可用于从海水中得到淡水 |
| D.装置④可用于排空气收集CO |
从分子的角度分析并解释下列事实,说法不正确的是
| 序号 |
事实 |
解释 |
| A |
碘酒是混合物 |
由不同分子构成 |
| B |
端午节粽飘香 |
分子在不断地运动 |
| C |
气体受热膨胀 |
温度升高,分子自身体积增大 |
| D |
碘受热升华 |
碘分子间的间隔增大 |
锂电池是一种新型的高能电池,质量轻、容量大,颇受手机、电脑等用户的青睐。某种锂电池的总反应式可表示为:Li十MnO2═LiMnO2下列说法错误的是
| A.该反应前后锂元素的化合价发生了变化 |
| B.MnO2中Mn的化合价为+4价 |
| C.LiMnO2属于氧化物 |
| D.该反应属于化合反应 |
下列应用与中和反应原理无关的是
| A.用浓硫酸干燥湿润的氧气 |
| B.用熟石灰改良酸性土壤 |
| C.服用含氢氧化铝的药物治疗胃酸过多 |
| D.用氢氧化钠溶液洗涤石油产品中的残留硫酸 |
下图是两种元素的原子结构示意图,据图分析,下列判断错误的是
| A.X是金属元素 |
| B.Y元素的原子在化学反应中易得到电子 |
| C.X和Y形成化合物的化学式为MgCl2 |
| D.X和Y两种元素的化学性质很相似 |
除去下列物质所含少量杂质,所用试剂或方法不正确的是
| 选项 |
物质 |
所含杂质 |
试剂或方法 |
| A |
CO |
H2 |
通入O2点燃 |
| B |
N2 |
O2 |
通过足量灼热的铜网 |
| C |
KNO3溶液 |
Ba(NO3)2 |
滴加适量K2SO4过滤 |
| D |
NaCl溶液 |
Na2CO3 |
滴加稀盐酸至不再产生气泡 |