粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
提供的试剂:饱和Na2CO3溶液、 饱和K2CO3溶液 、NaOH溶液、 KOH溶液、 BaCl2溶液 、Ba(NO3)2溶液
(1)欲除去溶液中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的各种试剂,按滴加顺序依次为 (填化学式);
(2)蒸发浓缩溶液Ⅱ得到的糊状物的化学成分最多的是(填化学式);
(3)用提纯过的NaCl固体来配制480 mL 0.4 mol·L-1NaCl溶液时,所用仪器除烧杯、药匙、玻璃棒、天平、胶头滴管外还有 (填仪器名称);需NaCl g。
(4)电解饱和食盐水的装置如图所示:
若收集到的H2为2 L,则同样条件下收集到的Cl2体积 (填“>”、“=”或“<”)2 L,其原因是: (文字描述);若将此装置的b口密封住,则电解一段时间后,U型管中可以获得一种消毒液,写出获得此消毒液的一个总反应方程式: 。
已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性。用如图所示装置进行Mg和SO2反应的实验。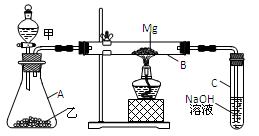
(1)选择制取SO2的合适试剂 。
①10%的H2SO4溶液②80%的H2SO4溶液
③Na2SO3固体④CaSO3固体
(2)写出装置乙和B中发生的主要反应的化学方程式:
;
。
装置C中NaOH溶液的作用是 。
(3)你认为该装置是否有不足之处? 。如果有,请说明 。
(共10分)某化学小组以环己醇制备环己烯(如下图),
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是___________,导管B除了导气外还具有的作用是_________;
②试管C置于冰水浴中的目的是____________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________ (填字母)洗涤;
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按右图装置蒸馏,冷却水从_________口进入(填字母)。蒸馏时要加入生石灰,目的是___________________;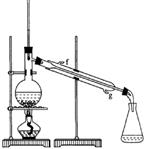
③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是______(填字母);
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_________(填字母)。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
“化学多米诺实验”是利用化学反应中气体产生的压力,使多个化学反应依次发生。下图所示就是一个“化学多米诺实验”,其中A~F装置中分别盛放的物质为:
| A.稀硫酸; | B.锌粒; |
| C.某溶液; | D.CaCO3固体;E、滴有紫色石蕊试液的蒸馏水;F、足量的澄清石灰水 |
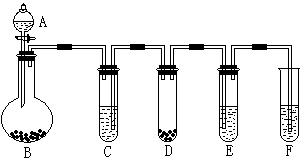
请回答下列问题:
⑴反应开始后,若E中出现红色,F中有白色沉淀生成,则C中的物质可能是
⑵写出装置D中反应的离子方程式:该反应的类型是:
装置F中反应的离子方程式:
⑶上图所示的B~F装置中,发生了氧化还原反应的是
(填装置编号)。请用单线桥表示出电子的转移
某实验需要80 mL、1 mol/L的Na2CO3溶液,现通过如下操作配制:
① 称量g Na2CO3固体放入小烧杯中,加适量蒸馏水溶解。为加快溶解可以使用玻璃棒搅拌
②待溶液冷却到室温后,小心转入(填仪器名称)
③继续加蒸馏水至液面至刻度线1~2cm处,改用(填仪器名称)小心滴加蒸馏水至溶液凹液面最低点与刻度线相切
④将容量瓶塞紧,充分摇匀。
⑤用少量蒸馏水洗涤玻璃棒和烧杯2~3次,每次洗涤的溶液都转入容量瓶,并轻轻摇匀
(1)操作步骤正确的顺序是(填序号)。
(2)使用容量瓶前必须进行的一项操作是
(3)若所配溶液的密度为1.06 g/mL,则该溶液的质量分数为。
(4)若取出20 mL配好Na2CO3的溶液,加蒸馏水稀释成c(Na+) ="0.1" mol/L的溶液,则稀释后溶液的体积为mL
(5)在配制Na2CO3溶液时,下列操作中的会导致结果偏低
①用拖盘天平称量时砝码放在左盘
②将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外
③定容时俯视刻度线
④未冷却到室温就转移到容量瓶中
⑤干净的容量瓶未经干燥就用于配制溶液
(6分) 如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题。
⑴ 图中有两处明显的错误是:①;
②。
⑵ A仪器的名称是,B仪器的名称是。
⑶ 实验时A中除加入少量自来水外,还需要加入少量的,其作用是。