红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基础化工原料。铬常见价态有+3、+6价。铬的主要自然资源是铬铁矿FeCr2O4(含有Al2O3、MgO、SiO2等杂质),实验室模拟工业以铬铁矿为原料生产红矾钠的主要流程如下:
①中主要反应:4 FeCr2O4 + 8Na2CO3 + 7O2  8Na2CrO4 + 2Fe2O3 + 8CO2
8Na2CrO4 + 2Fe2O3 + 8CO2
①中副反应:Al2O3 + Na2CO3 2NaAlO2 + CO2↑,SiO2 + Na2CO3
2NaAlO2 + CO2↑,SiO2 + Na2CO3 Na2SiO3 + CO2↑
Na2SiO3 + CO2↑
请回答下列问题:
(1)FeCr2O4化学名为亚铬酸亚铁,写出它的氧化物形式________________。步骤“①”的反应器材质应选用__________(填“瓷质”、“铁质”或“石英质”)。
(2)“②”中滤 渣1的成分是__________,“③”中调pH值是_______ (填“调高”或“调低”),“④”中滤渣2的成分是___________。
渣1的成分是__________,“③”中调pH值是_______ (填“调高”或“调低”),“④”中滤渣2的成分是___________。
(3)“⑤”酸化的目的是使CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:__________________________。
(4)上图是Na2Cr2O7·2H2O和Na2SO4的溶解度曲线,则操作I是______,操作II是______(填序号)。
①蒸发浓缩,趁热过滤②降温结晶,过滤
(5)已知某铬铁矿含铬元素34%,进行步骤①~④中损失2%,步骤⑤~⑦中产率为92%,则1吨该矿石理论上可生产红矾钠_______吨(保留2位小数)。
海水的综合利用可以制备金属镁,其流程如下图所示: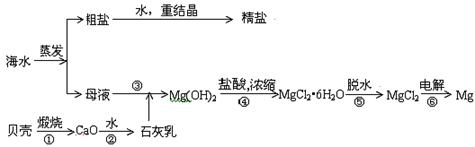
(1)写出①、③、⑥反应的化学方程式:
①, ③, ⑥。
(2)在反应①→⑥中属于氧化还原反应的是。
(3)
Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。
。
(4)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的;
溶解时:。过滤时:。蒸发时:。
关于卤化银分解实验的设计
有关卤化银的感光性,可按以下方法来进行实验:
试剂和仪器: 0.1 mol·L-1的NaCl、NaBr、KI溶液,2%的AgNO3溶液。500 mL圆底烧瓶、大烧杯、聚光电筒。
实验步骤:
(1)将3只预先注有4/5容积蒸馏水的圆底烧瓶用大烧杯垫托安置于讲台上,使之处于较好的视觉高度,编号。
(2)依次往上述烧瓶中加入2至5 mL NaCl、NaBr和KI溶液,振荡摇匀。
(3)慢慢地往烧瓶中滴加AgNO3溶液,边滴边振荡,可三名同学同时操作,3种胶体同时制作,便于比较。注意观察胶体形成的效果,要求胶体颜色明显,无浑浊状态。
(4)胶体制备好后,记录时间,用聚光电筒进行爆光(或置于阳光下),观察分解反应的速度及颜色等现象的变化,做好记录。
结论:分解速率:在同样光照条件下,AgBr分解最快,先由浅黄色透明状变成灰黑色浑浊态,时间约2 min;AgCl次之,由乳白透明状变成灰白浑浊态;AgI最慢,较长时间才略有变化。
问题:
1.你认为本实验有何优点?
2.18世纪70年代.瑞典化学家舍勒在研究一种白色、难溶于水的盐时发现,在黑暗中此盐并无气味,而在光照时开始变黑并有刺激性气味的气体产生。此盐是
A.氟化银 A.氯化银 C.溴化银 D.碘化银
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图:
(1)指出制取碘的过程中有关的实验操作名称:
①;②。
(2)提取碘的过程中.可供选择的有机试剂是。
| A.甲苯、酒精 | B.四氯化碳、苯 | C.汽油、乙酸 | D.汽油、甘油 |
(3)为使海藻灰中碘离子转化为碘的有机溶液.实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品.尚缺少的玻璃仪器是。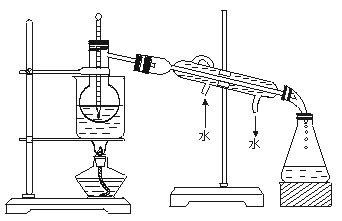
(4)从含碘的有机溶液中提取碘和回收有机溶液,还需要经过蒸馏。观察上述实验装置指出其错误之处,并加以改正。
(5)进行上述蒸馏操作时.使用水浴的原因是
。最后晶态碘在里聚集。
某同学为了验证海带中含有碘,拟进行如下实验,请回答相关问题。
(1)第1步:灼烧。操作是将足量海带灼烧成灰烬。该过程中将使用到的硅酸盐质实验仪器有(填代号、限填3项)。
A.试管 B.瓷坩埚 C.坩埚钳 D.铁三角架 E.泥三角 F.酒精灯 D.烧杯 H.量筒
(2) 第2步:I-溶液的获取。操作是。
(3)第3步:氧化。操作是依次加入合适的试剂。下列氧化剂最好选用(填代号)。
A.浓硫酸 B.新制氯水 C.KMnO4溶液 D.H2O2
理由是。
(4) 第4步:碘单质的检验。操作是取少量第3步的溶液,滴加淀粉溶液,如果溶液显蓝色,则证明海带中含碘。
海水占地球总储水量的97.2%,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。
(1)目前,国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经冷却而得高纯度淡水。由此可判断蒸馏法是 (填:物理变化或化学变化)。
(2)工业上利用电解饱和食盐水可制得重要化工产品。反应式为:食盐+H2O ® NaOH+H2+Cl2(未配平),该反应中食盐的化学式是 ;利用电解所得气体制36.5%的浓盐酸1000 t,最少需消耗食盐 t。
(3)近年来,有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法。该方法流程如下:
请写出②④的化学反应方程式: 、 。