下列离子方程式中正确的是( )
| A.稀硫酸滴在铜片上:Cu + 2H+ = Cu2++H2↑ |
B.硫酸钠与氯化钡溶液 混和:SO42- + Ba2+ = BaSO4↓ 混和:SO42- + Ba2+ = BaSO4↓ |
C.硝酸滴 在石灰石上:CaCO3+ 2H+= Ca2++H2CO3 在石灰石上:CaCO3+ 2H+= Ca2++H2CO3 |
| D.氧化铜与硫酸混和: Cu2+ + SO42-= CuSO4 |
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,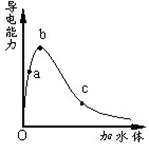
下列说法正确的是
| A.a、b、c三点溶液的pH:c<a<b |
| B.a、b、c三点醋酸的电离程度:a<b<c |
| C.用湿润的pH试纸测量a处溶液的pH,测量结果偏大 |
| D.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b |
以NA代表阿伏加德罗常数,则关于热化学方程式C2H2(g)+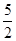 O2(g)
O2(g) 2CO2(g)+H2O(l)ΔH="-1" 300 kJ·mol-1的说法中,正确的是
2CO2(g)+H2O(l)ΔH="-1" 300 kJ·mol-1的说法中,正确的是
| A.当10NA个电子转移时,该反应放出1 300 kJ的能量 |
| B.当1NA个水分子生成且为液体时,吸收1300 kJ的能量 |
| C.当2NA个碳氧共用电子对生成时,放出1300 kJ的能量 |
| D.当8NA个碳氧共用电子对生成时,放出1300 kJ的能量 |
液氨与水性质相似,也存在微弱的电离:NH3 + NH3  NH4++ NH2-,其离子积常数k= c(NH4+)×c(NH2-)=2×10-30mol2·L2,维持温度不变,向液氨中加入NH4Cl固体或NaNH2固体,不发生改变的是
NH4++ NH2-,其离子积常数k= c(NH4+)×c(NH2-)=2×10-30mol2·L2,维持温度不变,向液氨中加入NH4Cl固体或NaNH2固体,不发生改变的是
| A.c(NH4+) | B.液氨的电离度 |
| C.c(NH2-) | D.液氨的离子积常数 |
298K下,将1mol蔗糖溶解在1L水中,此溶解过程中体系的∆G = ∆H-T∆S和∆S的变化情况是
| A.∆G>0,∆S<0 |
| B.∆G<0,∆S>0 |
| C.∆G>0,∆S>0 |
| D.∆G<0,∆S<0蔗糖从晶体变成溶液,混乱度增大,熵增加,故∆S>0. |
下列是4位同学在学习“化学反应速率和化学平衡”一章后,联系工业生产实际所发表的观点,你认为不正确的是
| A.化学反应速率理论是研究怎样在一定时间内快出产品 |
| B.化学平衡理论是研究怎样使用有限原料多出产品 |
| C.化学反应速率理论是研究怎样提高原料转化率 |
| D.化学平衡理论是研究怎样使原料尽可能多地转化为产品 |