用中和滴定法测定某烧碱的浓度。请回答在主要操作过程中的有关问题:
(1)将1.70g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200mL溶液。将0.20mol/L的盐酸标准溶液装入酸式滴定管,滴定时,锥形瓶中加2—3滴 作为指示剂;滴定过程中,左手控制活塞,右手旋转摇动锥形瓶,眼睛应注视 ,
当 时即为滴定终点。有关数据如下:
| 滴定序号 |
待测溶液体积(单位:mL) |
所消耗盐酸体积(单位:mL) |
||
| 滴定前读数 |
滴定后读数 |
消耗盐酸体积 |
||
| 1 |
20.00 |
0.50 |
20.60 |
V(平)= ________ |
| 2 |
20.00 |
6.00 |
26.00 |
(2) 计算:测得NaOH溶液的浓度为____________mol/L,烧碱样品的纯度为
(3)若该学生测定值偏大了,则引起测定误差的可能原因是_______________________
A.酸式滴定管用水洗后,未用标准酸液润洗
B.酸式滴定管尖嘴部分有气泡未排除,滴定后气泡消失
C.锥形瓶用蒸馏水洗后,未用碱液洗
D.酸式滴定管起始读数俯视,滴定后读数仰视
E.在滴定过程中向锥形瓶中添加少量蒸馏水
F.取待测液时,碱式滴定管未用碱液洗
G.当指示剂局部变色时,停止滴定
如图所示,A是制取溴苯的实验装置,B、C是改进后的装置。请仔细分析,对比三个装置,回答下列问题: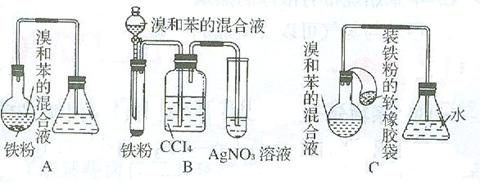
(1)写出三个装置中共同发生反应的化学方程式:___________________
(2)装置A和C均采用了长玻璃导管,其作用是_____________________________
(3)按装置B、C装好仪器及药品后,要使反应开始,应对装置B进行的操作是_________,应对装置C进行的操作是 ___________________________________。
(4)装置B、C较好地解决了A中加装药品和使装置及时密封的矛盾,方便了操作,装置A中这一问题在实验中造成的后果是________________________。
(5)B中采用了洗气瓶吸收装置,反应后洗气瓶中可能出现的现象是_______
(10分)实验室用乙醇与浓硫酸共热制取乙烯,常因温度过高生成少量SO2,有人设计了如下图所示实验,以验证上述混合气体中是否含有乙烯和SO2。
(1)装置中X仪器的名称是:;
碎瓷片的作用是:。
(2)写出生成乙烯的化学反应方程式:。
(3)A、B、C、D装置中可盛放的试剂是(从下列所给试剂中选出,填序号):
①品 红溶液,②NaOH溶液,③溴水,④KMnO4酸性溶液。
红溶液,②NaOH溶液,③溴水,④KMnO4酸性溶液。
A.;B.;C.;D.。
(4)能说明SO2气体存在的现象是。
(5)确证含有乙烯的现象是。
(8分)请选用适当的试剂和分离方法除去下列物质中所含的杂质(括号内为杂质),将所选的试剂及分离方法的编号填入表中。
试 剂: a.水 b.NaOH溶液 c.溴水 d.饱和Na2CO3溶液 e.新制CaO
分离方法:①.分液②.过滤③.洗气④.蒸馏
| 混合物 |
需加入的试剂 |
分离方法 |
| 溴苯(溴) |
||
| 乙烷(乙烯) |
||
| 乙醇(水) |
||
| 乙酸乙酯(乙酸) |
下图是实验室用来验证乙烯与氢气反应产物的装置,请回答下列问题:湖北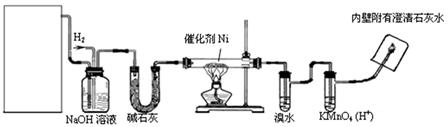
(1)方框内装置用来制取乙烯,现有下列仪器及用品:①碎瓷片②石棉网和铁架台③圆底烧瓶④温度计(量程100℃)⑤温度计(量程200℃)⑥酒精灯⑦单孔塞⑧双孔塞⑨导管。
其中不需用的仪器及用品有(填序号)湖北
(2)写出制乙烯化学方程式:
(3)碱石灰的作用是:
(4)溴水的作用是:
(5)出现什么现象可说明生成了乙烷?
为检验浓硫酸与木炭在加热条件下反应产生的SO2和CO2气体,设计了如图所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉。
请回答下列问题:
(1)实验前欲检查装置A的气密性,可以采取的操作是;
(2)此实验成败的关键在于控制反应产生气体的速率不能过快,由此设计了虚框部分的装置,则正确的操作顺序是(用操作编号填写)
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(3)实验时,装置C中的现象为;
(4)当D中产生(多选不得分)现象时,可以说明使E中澄清石灰水变浑浊的是CO2,而不是SO2;
A.进气口一端脱脂棉蓝色变浅,出气口一端脱脂棉蓝色不变
B.脱脂棉上蓝色均变浅
C.脱脂棉上蓝色褪去
装置D的作用为
发生反应用化学方程式可表示为。