有机物A的结构简式是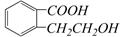 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质:
B.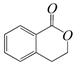 C.
C. D.
D.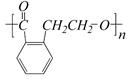 E.
E.
(1)A中含氧官能团的名称: ;
(2)写出由A制取B的化学方程式: ;
(3)写出A制取C、D、E三种物质的有机反应类型:C D E ;
(4)写出两种既可以看做酯类又可以看做酚类,且分子中苯环上连有三种取代基的A的同分异构体的结构简式(要求这两种同分异构体分子中苯环上的取代基至少有一种不同):
、 。
在Fe2(SO4)3和CuSO4的混合溶液中加入铁和铜的混合物,用玻璃棒搅拌使之充分反应。不考虑阴离子,从“ Fe3+、Fe2+、Cu2+、Fe、Cu ”中选择合适的符号填写:
(1)若有固体剩余,且加盐酸后产生氢气,则剩余固体有;溶液中没有离子。
(2)若向反应后溶液中滴加KSCN,溶液变红色,则可能固体剩余(填“有”或“无”);
溶液中有离子。
(3)若只有铜粉剩余,则溶液中肯定有离子;离子有可能存在。
(1)磁铁矿的主要成分是;
(2)钾云母的化学式是K2H4Al6Si6O24,以氧化物形式可表示为;
(3)向FeSO4溶液中滴加NaOH溶液,实验现象是;
(4)高温分解碳酸钙,选择合适的坩埚(A.瓷坩埚 B.铁坩埚 C.氧化铝坩埚)
(5)生产玻璃的原料有、、石灰石
(6)用于太阳能电池板,进行光电转化的重要半导体材料,其主要成分是 ,
(7)写出一种和氯水漂白原理相同的物质。
按要求写出下列反应的方程式
(1)工业用石英制取粗硅的反应方程式:_______________________________;
(2)工业用赤铁矿做原料炼铁的反应方程式:;
(3)金属铝与NaOH溶液反应的离子方程式:_______________________________;
(4)FeSO4溶液中滴加双氧水的离子方程式:;
(5)酸性条件下, MnO4—被SO2还原为Mn2+的离子方程式:___________________________;
A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
(1)若B是气态氢化物。C、D是氧化物且会造成光化学烟雾污染。写③反应的化学方程式。
(2)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写④反应离子方程式。
(3)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中除钠、氧外的元素均为同一主族,且溶液均显碱性。写出②反应的化学方程式。
(4)若A是当今应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写出该反应的离子方程式。
短周期元素X、Y、Z、W在周期表中的位置如图所示,其中W的氧化物是形成酸雨的主要物质之一。
| X |
|||
| Z |
W |
Y |
(1)写出W的原子结构示意图:。
(2)已知:
①X(s) + O2(g) =XO2(g)ΔH=-393.5 kJ·mol-1
②H2(g) + 1/2 O2(g) =H2O(g)ΔH=-242.0 kJ·mol-1
③XH4(g) + 2O2(g) =XO2(g) + 2H2O(g)ΔH=-802.0 kJ·mol-1
则XH4气体分解成氢气和X固体的热化学方程式为。
(3)ZO是由单质X和ZO2反应制取单质Z的中间产物(空气中极不稳定)。隔绝空气时,ZO与NaOH溶液反应(产物含有一种固体单质和一种钠盐)的化学方程式为__________________________。
(4)元素Y的Ca盐和H2为原料,反应产物只有甲和乙两种且均为化合物。研究发现:化合物甲的组成中钙、元素Y的质量分数分别为52.29%、46.41%;化合物乙的水溶液显酸性。则乙的化学式为;甲与水反应可得H2,其化学方程式是:。
(5)将W的气态氢化物通入一定量的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,生成气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)。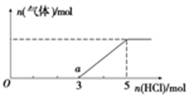
①O点溶液中所含溶质的化学式为____________。
②a点溶液中,c(Na+):c(Cl-)= _______________。