亚硝酸钠属剧毒物质,是一种食品护色剂。人体摄入过多的亚硝酸钠,30min即出现恶心、呕吐、全身 无力、皮肤青紫等中毒症状,严重者昏迷、抽搐、呼吸衰竭而死亡。我国因亚硝酸钠严重污染或以“工业盐”(亚硝酸钠)作为食盐误食引起恶性食物中毒事故屡有发生。所以 ,在肉制品加工中使用护色剂必须严格控制其使用量,确保食用安全。
(1) 已知NaNO2能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O,反应中氧化剂是_________,若有2mol NaNO2发生反应转移电子的物质的量_________mol。
(2)根据上述反应,可以用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有①自来水②碘化钾淀粉试纸③淀粉④白糖⑤食醋⑥白酒。进行实验时,必须选用的物质有_____________。
(3)若误食亚硝酸盐会导致血红蛋白中亚铁离子转化为铁离子而中毒。服用维生素C可解除亚硝酸盐中毒。下列叙述正确的是_________。
| A.亚硝酸盐是还原剂 | B.维生素C是还原剂 |
| C.维生素C能把亚铁离子氧化为三价铁离子 | D.亚硝酸盐被氧化 |
氮是地球上含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用。
(1)下图是1mol NO2气体和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2气体和CO反应的热化学方程式:。
(2)在固定体积的密闭容器中,进行如下化学反应: N2(g) +3H2(g) 2NH3(g);
2NH3(g);
①下列各项能说明该反应一定达到平衡状态的是(填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(H2)(逆) =)3v(N2)(正)
c.容器内压强保持不变 d.混合气体的密度保持不变
②若上述反应达到平衡时,N2、H2、NH3的浓度之比为1:3:2,再向容器中按物质的量之比为1:3:2通入N2、H2、NH3,与原平衡相比,N2的物质的量浓度(填增大、不变或减小,下同),NH3的体积分数。
(3)科学家一直致力研究常温、常压下“人工固氮”的新方法。请回答下列问题:
目前工业合成氨的原理是:N2(g)+3H2(g) 2NH3(g);△H<0。
2NH3(g);△H<0。
①下图表示随条件改变,平衡混合气体中氨气的百分含
量的变化趋势。当横坐标为压强时,变化趋势正确的是(选填字母序号,下同)_____________;当横坐标为温度时,变化趋势正确的是_________________。
②液氨与水相似,存在着微弱的电离,写出液氨发生电离的方程式: ___________________________
下图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑、6 mol/L H2SO4溶液和NaOH溶液。填写下列空白: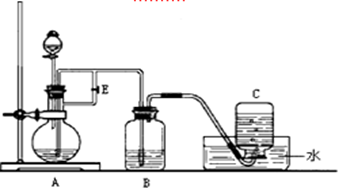
(1)B中盛有一定量的,A中应预先加入的试剂是,A中反应的化学方程式为。
(2)实验开始时应先将活塞E(填“打开”或“关闭”),目的是。
(3)A反应一段时间后将活塞E(填“打开”或“关闭”),目的是
。
(4)实验结束,拔去装置B中的橡皮塞,使空气进入,Fe(OH)2被氧化。若反应过程中转移了0.04mol电子,则参加反应的氧气的体积为L(标准状况)。
用18mol/L 浓硫酸配制100ml 3.0mol/L 稀硫酸的实验步骤如下:①计算所用浓硫酸的体积,②量取一定体积的浓硫酸,③溶解,④检漏、转移、洗涤,⑤定容、摇匀。回答下列问题:
(1)所需浓硫酸的体积是(保留到小数点后一位),量取浓硫酸所用的量筒的规格是(从下列中选用:A. 10ml B. 25ml C. 50ml D. 100ml)
(2)在上述实验步骤中,需要用到 玻璃棒的有(填序号)。
玻璃棒的有(填序号)。
(3)第⑤步实验的操作是:继续向容量瓶注入蒸馏水至离刻度线1-2cm处,改用胶头滴管向容量瓶滴加至为止。塞紧瓶塞,倒转摇匀。
(4)下列情况对所配制的稀硫酸浓度有何影响?(填“偏大”、“偏小”或“无影响”)
A. 所用的浓硫酸长时间放置在密封不好的容器中
B. 容量瓶用蒸馏水洗涤后残留有少量的水
C. 所用过的烧杯、玻璃棒未洗涤
D. 定容时俯视溶液的凹液面
工业上常用大理石等原料制取安全无毒的杀菌剂过氧化钙(CaO2)。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:

 (1)溶解大理石时,用硝酸而不用硫酸的原因是
(1)溶解大理石时,用硝酸而不用硫酸的原因是
。 (2)操作Ⅱ中加入的A是少量的氨水,其目的是。
(2)操作Ⅱ中加入的A是少量的氨水,其目的是。 (3)写出滤液B的一种用途:。
(3)写出滤液B的一种用途:。 (4)写出检验滤液B中是否含Fe3+的方法是
(4)写出检验滤液B中是否含Fe3+的方法是 。
。
 (5)写出加入碳酸铵所发生反应的离子方程式:。
(5)写出加入碳酸铵所发生反应的离子方程式:。
(6)CaO2与水反应会放出氧气,化学方程式为。
由A和B两种盐组成的混合物,进行了下列实验: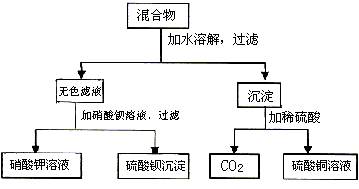
试判断,A、B分别是。
写出实验过程中加水时时发生反应的离子方程式。