①常温下,0.05mol/L硫酸溶液中,C(H+)= mol/L,
水电离的C(H+)= mol/L
②某温度,纯水中C(H+)==3×10-7mol/L,则:
纯水中C(OH-)="=" mol/L,此时温度 (填“高于”“低于”或“等于”)25℃。若温度不变,滴入盐酸后C(H+)=5×10-4mol/L,
则溶液中C(OH-)= mol/L,由水电离的C(H+)="=" mol/L。
(12分)一定温度下,向如图所示带有可移动活塞的密闭容器中充入2 L SO2和1 L O2的混合 气体,发生如
气体,发生如 下反应2 SO2 (g) + O2 (g)
下反应2 SO2 (g) + O2 (g) 
 2 SO3 (g
2 SO3 (g ) 。
) 。
(1) 若活塞可自由移动,平衡后,活塞停止在“2.1”处该反应中SO2的转化率为。
(2) 若开始时,充入容器的起始物质分别是
①2 L SO2和1 L O2;
②2 L SO3 (g) 和 1 L N2 ;
③1 L SO2、1 L O2和 1 L SO3 (g),
使活塞固定在“3”处,达到平衡后,容器中SO3 (g)占反应混合物的体积分数的大小关系是:(用序号①②③和“<”、“=”、“>”表示)。
(3) 向(1)平衡后的容器中充入0.2 mol 的SO3,活塞移动后再次达到平衡时,测得此过程中从外界共吸收了1.96 kJ 的热量。写出SO2发生氧化反应的热化学方程式: _______________。
_______________。
(9分) 如图所示,一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g) + 2H2(g)  CH3OH(g)
CH3OH(g)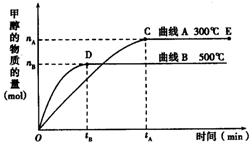
上述可逆反应正反应为___________反应(填“放热”或“吸热”)。
在500℃,从反应开始到平衡,氢气的平均反应速率v(H2) =___________________________(用nB、tB表示)。
对处于E点的体系,改变外界条件使平衡向正反应方向移动时,下列有关该体系的说法正确的是______________________(填字母)。
| A.H2的转化率一定增大 | B.v正一定增大,v逆一定减小 |
| C.CH3OH的质量分数一定增加 | D.v逆一定小于v正 |
(8分 ) CH3OH(g)+H2O(g)
) CH3OH(g)+H2O(g) CO2(g)+3H2(g);该反应的正反应为吸热反应,请根据题目要求回答下列问题:
CO2(g)+3H2(g);该反应的正反应为吸热反应,请根据题目要求回答下列问题:
(1)在其它条件不变的情况下降低温度,则逆反应速率 (填“增大”或“减小”或“不变”,下同 );在其它条件不变的情况下加压,则正反应速率
);在其它条件不变的情况下加压,则正反应速率 。
。
(2)一定条件下,向体积为2L的密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为。
(3)判断该可逆反应达到平衡状态的依据是(填序号)。
| A.v正(CH3OH)=v正(CO2) | B.混合气体的密度不变 |
| C.混合气体的平均相对分子质量不变 | D.CH3OH、H2O、CO2、H2的浓度都不再发生变化 |
已知25℃、101kpa时,一些物质的燃烧热为:
| 化学式 |
CO(g) |
H2(g) |
CH3OH(l) |
CH4(g) |
| △H/(kJ/mol) |
-283.0 |
-285.8 |
-726.5 |
-890.3 |
请回答下列问题。
(1)写出该条件下CH3OH(l )完全燃烧的热化学方程式:。
)完全燃烧的热化学方程式:。
(2)根据盖斯定律完成下列反应的热化学方程式:CO(g)+ 2H2(g)= CH3OH(l);△H=。
(3)现有H2和CH4的混合气体112 L( 标准状况),使其完全燃烧生成CO2(g)和H2O(l),共放出热量3242.5 kJ,则原混合气体中H2和CH4的物质的量之比是:
标准状况),使其完全燃烧生成CO2(g)和H2O(l),共放出热量3242.5 kJ,则原混合气体中H2和CH4的物质的量之比是:
| A.1∶1 | B.1∶3 | C.1∶4 | D.2∶3 |
氨气是氮循环中的重要物质,在人类的生产和生活中有着广泛的应用。
(1)如图是N2与H2反应过程中能量变化的示意图,则该反应生成液态氨的热化学方程式是______ ________________。
________________。
(2).若由N2和H2合成1molNH3时可放出46.2kJ/mol的热量。从手册上查出N≡N键的键能是948.9kJ/mol,H-H键的键能是436. 0kJ/mol,则N-H键的键能是________ kJ/mol。