下列离子方程式正确的是 ( )
| A.碳酸钠溶液中通入过量SO2气体:CO32-+2SO2 +H2O=CO2↑+2HSO3- |
| B.实验室制H2S:CuS+2H+= Cu2++H2S↑ |
C.氯化铵和氢氧化钙固体混合加热制氨气:NH4++OH- NH3 ↑+H2O NH3 ↑+H2O |
| D.实验室制氯气:2MnO4-+8H++6Cl-=2MnO2+3Cl2↑+4H2O |
[2012·课标全国卷] 短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同。X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,而Z不能形成双原子分子。根据以上叙述,下列说法中正确的是( )
| A.上述四种元素的原子半径大小为W<X<Y<Z |
| B.W、X、Y、Z原子的核外最外层电子数的总和为20 |
| C.W与Y可形成既含极性共价键又含非极性共价键的化合物 |
| D.由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
[2012·江门调研]下列热化学方程式中,正确的是()
A.甲烷的燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-890.3kJ·mol-1
B.含20.0g的NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.4 kJ·mol-1
D.已知:2Zn(s)+O2(g)=2ZnO(s)ΔH=-701.0kJ/mol
2Hg(l)+O2(g)=2HgO(s)ΔH=-181.6kJ/mol
则Zn(s)+HgO(s)=ZnO(s)+Hg(l)ΔH=-259.7 kJ·mol-1
[2012·北京丰台一模]根据碘与氢气反应的热化学方程式,下列判断正确的是()
① I2(g)+H2(g)  2HI(g)△H=-9.48 kJ·mol-1
2HI(g)△H=-9.48 kJ·mol-1
② I2(s)+H2(g)  2HI(g)△H=+26.48 kJ·mol-1
2HI(g)△H=+26.48 kJ·mol-1
| A.254g I2(g)中通入2g H2(g),反应放热9.48 kJ |
| B.当反应②吸收52.96kJ热量时转移2mole一 |
| C.反应②的反应物总能量比反应①的反应物总能量低 |
| D.1 mol固态碘与1 mol气态碘所含能量相差17.00 kJ |
向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是
A.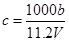 |
B.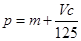 |
C.n=m+17Vc | D.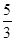 m<p< m<p< |
25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是 ( )
A.2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(1)△H=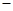 57.3 kJ/mol 57.3 kJ/mol |
B.KOH(aq)+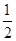 H2 SO4(aq)= H2 SO4(aq)=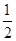 K2SO4(aq)+H2O(l)△H= K2SO4(aq)+H2O(l)△H=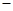 57.3kJ/mol 57.3kJ/mol |
C.C8H18(I)+ O2(g)=8CO2(g)+9H2O△H= O2(g)=8CO2(g)+9H2O△H=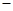 5518 kJ/mol 5518 kJ/mol |
D.2C8H18(g)+25O2(g)=16CO2(g)+18H2O(1)△H=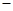 5518 kJ/mol 5518 kJ/mol |