在FeSO4溶液中滴加入少量KSCN溶液,溶液颜色 ,
再滴入几滴氯水,溶液颜色 ,因为有 生成。
实验室配制的FeCl2溶液由于各种原因很容易变质,为了防止其水解,我们经常在里面加入____;为了防止其被氧化,经常加入_____,相应的化学反应方程式为_________________。_______
(1)某化学反应可用下式表示:A + B ="=" C + D + H2O ,若A、D均可用于消毒,且C是家家户户的厨房必备的物质之一,
写出该反应的离子方程式:
(2)硝酸铅的稀溶液中,滴入几滴稀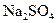 生成白色
生成白色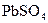 沉淀,再滴入数滴饱和NaAc溶液,微热,并不断搅动,沉淀慢慢溶解,以上发生的都是复分解反应,写出反应过程的离子方程式
沉淀,再滴入数滴饱和NaAc溶液,微热,并不断搅动,沉淀慢慢溶解,以上发生的都是复分解反应,写出反应过程的离子方程式
①②
(3)边微热边向铵明矾[NH4Al(SO4)2`12H2O]溶液中逐滴加入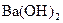 溶液至中性
溶液至中性
(提示:NH+ 4 、Al3+恰好完全反应)
①此时发生反应的离子方程式为
②向以上所得中性溶液中继续滴加稀硫酸,相关反应的离子方程式是:
硝酸与金属反应时,浓度越稀还原产物价态越低。现用一定量的铝粉与镁粉组成的混合物与100ml硝酸钾溶液与硫酸组成的混合溶液充分反应,反应过程中无任何气体放出,相反应后的溶液中逐滴加入4.00mol/L的NaOH溶液,加入的溶液体积与与产生的沉淀质量的关系如图所示。
回答下列问题:
(1)写出铝与混合溶液反应的离子方程式:
(2)参加反应硝酸根离子物质的量为mol
(3)参加反应的铝与镁的质量之比为
(4)混合液中硫酸的物质的量的浓度为mol/L
用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯。
(1)完成该反应的化学方程式:(系数按顺序填在答题卷上)
___ C+ ___ KMnO4+ ____ H2SO4→____CO2↑+ ____MnSO4 + ____K2SO4+ ____
(2)反应的氧化剂是,被还原的元素名称是;
(3)H2SO4在上述反应中表现出来的性质是(填选项编号)
| A.酸性 | B.氧化性 | C.吸水性 | D.脱水性 |
(4)上述反应中若产生2.24L(标准状况下)CO2气体,则转移的电子数是。
A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去)。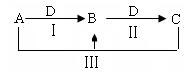
(1)若A为氯碱工业的产品,C为厨房中 的用品。
的用品。
①D的电子式是 。
。
②反应Ⅲ的离子方程式是。
③氯碱工业制备A的化学方程式是
 ,其中两种产物可与KI溶液反应制得一种化工原料,若消耗0.1 mol KI转移电子0.6 mol,则三种物质间反应的离子方程式是
,其中两种产物可与KI溶液反应制得一种化工原料,若消耗0.1 mol KI转移电子0.6 mol,则三种物质间反应的离子方程式是 。
。
(2)若A、D均为单质,且A为黄绿色气体 ,D元素的一种红棕色氧化物常用作颜料。
,D元素的一种红棕色氧化物常用作颜料。
①反应Ⅲ的离子方程式是。
②B可作净水剂,其原理是 (用离子方程式表示)。在使用时发现B不能使酸性废水中的悬浮物沉降除去,其原因是。
(用离子方程式表示)。在使用时发现B不能使酸性废水中的悬浮物沉降除去,其原因是。
已知X、Y、Z、W是短周期常见非金属元素,它们的原子序数依次增大,X元素原子形成的离子就是一个质子,Z、W在周期表中处于相邻位置,它们的单质在常温下都是气体,Y原子的最外层电子数是内层电子数的2倍。
(1)写出元素符号:X____、Y____、Z____、W____。
(2)、按X、Y、Z、W的顺序,这四种元素可组成原子个数比为5:1:1:3的化合物,该化合物与足量的氢氧化钠溶液反应的离子方程式为__ ______。
______。
(3)、将9gY单质在足量W单质中燃烧,所得气体通入1L1mol/LNaOH 溶液中,充分反应后溶液中含的溶质有(填化学式)________,其物质的量分别是________。
溶液中,充分反应后溶液中含的溶质有(填化学式)________,其物质的量分别是________。