常温下,在溶液中可发生以下反应:① ===
=== ,
,
② ===
=== , ③
, ③ ===
=== ,
,
由此判断下列说法错误的是( )
A.还原性强弱顺序为: |
| B.Z元素在反应①中被氧化,在③中被还原 |
C.常温下可发生反应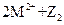 === ===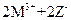 |
D.氧化性强弱顺序为: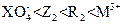 |
下列说法正确的是
| A.熔化干冰和熔化NaCl晶体所克服的作用力相同 |
| B.氢键比分子间作用力强,所以它属于化学键 |
| C.H2O是一种非常稳定的化合物,这是由于氢键所致 |
| D.冰的密度比水小,这是由于冰中存在氢键所致 |
下列关于化石燃料及其加工说法正确的是
| A.天然气和沼气的主要成分都是甲烷,二者都是不可再生资源 |
| B.石油分馏和煤干馏都是物理变化,前者可得到汽油、煤油等,后者主要得到焦炭、煤焦油、粗氨水和焦炉气 |
| C.石油裂化主要是为了提高轻质油的产量,尤其是汽油的产量 |
| D.煤的液化指的是把煤加热到熔点以上使其变成液体 |
意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的气态N4分子,其分子结构如图所示。已知断裂1mol N-N吸收167kJ热量,生成1 mol N≡N放出942kJ热量,根据以上信息判断,下列说法正确的是
| A.1mol N4转变成N2将放出882kJ热量 | B.N4属于一种新型的化合物 |
| C.N4与N2互为同分异构体 | D.N4是由极性键组成的分子 |
下列反应既属于氧化还原反应,又是吸热反应的是
| A.铝与稀盐酸的反应 | B.甲烷在氧气中的燃烧反应 |
| C.灼热的木炭与CO2反应 | D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应 |
下列说法正确的是
| A.天然气和沼气的主要成分是乙烯,它们都属于不可再生能源 |
| B.煤是复杂的混合物,含有苯、甲苯、二甲苯等一系列重要的化工原料 |
| C.石油分馏得到的汽油、煤油、柴油等都是混合物,但有固定的熔沸点 |
| D.石油炼制的目的是为了获得轻质油和重要化工原料(乙烯、丙烯等) |