25℃时,水的电离可达到平衡:H2O H++OH—,下列叙述正确的是
H++OH—,下列叙述正确的是
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.将水加热,Kw增大,pH不变 |
下列说法正确的是
A.硝基苯的结构简式为 |
B.表示甲烷分子或四氯化碳分子的比例模型 |
| C.等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等 |
D.结构片段为 的高聚物,其单体是甲醛和苯酚 的高聚物,其单体是甲醛和苯酚 |
下列物质分类正确的是
| A.SO2、SiO2、CO均为酸性氧化物 |
| B.福尔马林、水玻璃、氨水均为混合物 |
| C.烧碱、冰醋酸、四氯化碳均为电解质 |
| D.稀豆浆、硅酸、氯化铁溶液均为胶体 |
用NA表示阿伏加德罗常数的值。下列叙述中正确的是
| A.8 g甲烷含有的共价键数约为NA |
| B.常温常压下,22.4 L二氧化碳原子总数为3NA |
| C.1 mol Fe与稀HNO3反应,一定转移3 NA个电子 |
| D.1mol单质硅含有2molSi-Si键 |
一定条件下,在一固定容积的密闭容器中发生如下反应:N2(g)+3H2(g) 2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若同条件下开始时充入a mo N2和3a mol H2的混合气体,求:
2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若同条件下开始时充入a mo N2和3a mol H2的混合气体,求:
(1)达到平衡时H2的转化率;
(2)平衡时NH3在混合气体中的体积分数。
一定条件下,在一固定容积密闭容器中发生如下反应:N2(g)+3H2(g) 2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若开始时充入a mo N2和3a mol H2的混合气体,求:
2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若开始时充入a mo N2和3a mol H2的混合气体,求:
(1)达到平衡时H2的转化率;
(2)平衡时NH3在混合气体中的体积分数。
已知甲为恒压容器、乙为恒容容器。相同条件下充入等物质的量的NO2气体,且起始时体积相同。发生反应:2NO2(g)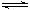 N2O4 (g)△H<0。一段时间后相继达到平衡状态。下列说法中正确的是
N2O4 (g)△H<0。一段时间后相继达到平衡状态。下列说法中正确的是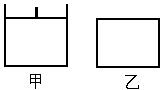
| A.平衡时NO2体积分数:甲<乙 |
| B.达到平衡所需时间,甲与乙相等 |
| C.该反应的平衡常数表达式K=c(N2O4)/c(NO2) |
| D.若两容器内气体的压强保持不变,均说明反应已达到平衡状态 |