在一容积为3 L的密闭容器内加入0.3 mol的N2和0.9 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)  2NH3 ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:(1)根据图示,计算从反应开始到平衡时,平均反应速率v(NH3)________。(2)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
2NH3 ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:(1)根据图示,计算从反应开始到平衡时,平均反应速率v(NH3)________。(2)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为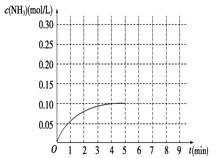
a.0.20 mol/L b.0.12 mol/L c.0.10 mol/L d.0.08 mol/L
(3)反应达到平衡后,第5分钟末,保持其它条 件不变,若只把容器的体积缩小一半,平衡 移动 (填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数 _(填“增大”、“减小”或“不变”)
件不变,若只把容器的体积缩小一半,平衡 移动 (填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数 _(填“增大”、“减小”或“不变”)
请回答下列实验室中制取气体的有关问题。
(1)如图是用KMnO4与浓盐酸反应制取适量氯气的简易装置。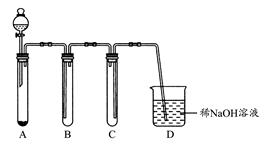
装置B,C,D的作用分别是:B;C;D。
(2)在实验室欲制取适量NO气体。
①下图中最适合完成该实验的简易装置是(填序号);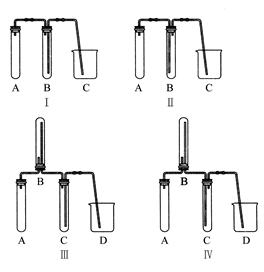
②根据所选的装置完成下表;(不需要的可不填)
| 应加入的物质 |
所起的作用 |
|
| A |
||
| B |
||
| C |
||
| D |
③简单描述应观察到的实验现象。
某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验。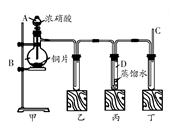
请回答下列问题:
(1)装置甲中盛放浓硝酸的仪器A的名称是,该装置中发生反应的化学方程式为。
(2)实验过程中,装置乙、丙中出现的现象分别是;装置丙中的试管内发生反应的离子方程式为。
(3)为了探究NO的还原性,可以在装置丁的导气管C中通入一种气体,通入的这种气体的名称是。
(4)取下装置丙中的试管D,在其中滴加FeSO4溶液,溶液变为色,为了证明铁元素在该反应中的产物,可以再在溶液中滴加KSCN溶液,溶液变为色。
某学生用实验室常见的酸、碱、盐和金属单质为反应物,并利用一个底部有小孔的试管和一个广口瓶组装成如图所示的装置。试回答: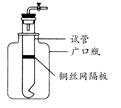
(1)若试管中装有铜丝网隔板,利用该装置可制取哪些气体?
(写出两种)。
(2)若将铜丝网隔板改为铁丝网隔板,则该装置可用于制取何种气体?。该反应的离子方程式是:。
下表是实验室制备气体的有关内容:
| 编号 |
实验内容 |
实验原理 |
气体发生装置 |
| ① |
制氧气 |
H2O2―→O2 |
|
| ② |
制氨气 |
NH4Cl―→NH3 |
|
| ③ |
是氯气 |
HCl―→Cl2 |
(1)上表气体中:从制备过程看,必须选择合适的氧化剂才能实现的是________(填气体的化学式,下同);从反应原理看,明显不同于其他两种气体的是________。
(2)根据表中所列实验原理,从下列装置中选择合适的气体发生装置,将其编号填入上表中的空格中。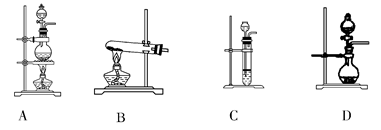
(3)若用上述制备O2的装置制备NH3,则选择的试剂为________________。
(4)制备Cl2需用8 mol·L-1的盐酸100 mL,现用12 mol·L-1的盐酸来配制。
①为提高配制的精确度,量取浓盐酸的仪器可选用下列中的________(填序号):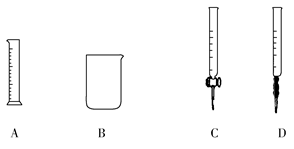
②配制过程中,除上图所列仪器外,还需要的仪器有________、________、________。
请你利用下列装置来证明浓硫酸与足量锌反应时可得到SO2、H2两种气体,所需试剂自选。
(1)在下面的方框中,画出实现上述实验目的的装置示意图(仪器选自于下图,夹持装置、连接胶管、橡皮塞及尾气处理装置不必画出,也不必标出装置内试剂,需要加热的仪器下方用△标出),按气流流向在每件仪器下方标出字母A、B、C……其他可选用的仪器(数量不限)简易表示如下:
(2)根据方框中的装置图,填写下表:
| 仪器符号 |
仪器中所加物质 |
作用 |
| 最后一种装置(作图时请对其编号) |
浓硫酸 |
防止空气中水蒸气进入E中干扰实验 |