A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数比次外层电子数少2;A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物。请回答:
(1)C和E两种元素相比较,原子得电子能力较强的是(填元素名称) ,以下三种说法中,可以验证该结论的是(填写编号) ;
A.比较这两种元素的常见单质的沸点
B.二者形成的化合物中,C元素的原子显负价
C.比较这两种元素的气态氢化物的稳定性
(2)C与D形成的某种化合物可作潜水面具中的供氧剂,每生成标准状况下11.2LO2,消耗该化合物的质量为___________。
(3)A、B、C、E可形成两种酸式盐(均含有该四种元素),这两种酸式盐在水溶液中相互反应的离子方程式为 。
右图为实验室制取蒸馏水的装置示意图。请根据图示回答下列问题: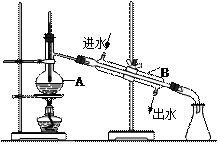
⑴ 图中两处明显的错误是:
,
。
⑵ A仪器的名称是 ,B仪器的名称是。
,B仪器的名称是。
⑶ 实验时A中除加入适量自来水外,还需加入少量,其作用是。
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO以及泥沙等杂质,一位同学设计了一种制备精盐的实验方案,步骤如下(用于生成沉淀的试剂均稍过量):

(1) 判断BaCl2已过量的方法是______________________________。
(2) 第④步中,相关的离子方程式是_________________________________。
(3)蒸发、结晶时,当中剩余时停止加热。
根据反应8NH3 + 3Cl2 ="=" 6NH4Cl+ N2 ,回答下列问题:
(1) 还原剂是(写化学式);
(2) 用双线桥法表示该反应电子转移的方向和数目;
(3)当反应中转移1.806×1024个电子时,被氧化的气体在标准状况下的体积为升。
某中学环境监测兴趣小组的同学在一条鱼虾绝迹的小河边发现甲、乙、丙、丁四个工厂 ,如右图所示。这些工厂往小河里排放的废水中各含一种化合物。经检测发现:①甲处河水呈浅黄色;②乙处河水呈红褐色浑浊状;③丙处河水逐渐变澄清;④丁处河水不断冒气泡;⑤M处水样的pH大于7,加入足量的稀HNO3后再加入BaCl2溶液,无沉淀生成; ⑥N处水样的 pH小于7。请回答: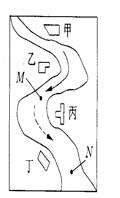
(1)四个工厂所排放的废水中,分别含有下列化合物中的哪种物质:
硫酸铁、氢氧化钠、硝酸银、碳酸钠、氯化铁、硫酸。
甲______,乙______,丙______,丁______。(均填化学式)
(2)写出丙、丁两处所发生反应的离子方程式:
丙_______________; 丁_______________。
四只失去标签的试剂瓶中分别盛有NaCl溶液、NaNO3溶液、Na2CO3溶液和Na2SO4溶液,就如何检验这四种溶液做如下实验:先用四只试管分别取四种溶液各1mL, ① 在四只试管中分别滴入过量的同一种试剂,根据反应现象检验出一种物质;② 在剩余的三只试管中分别滴入第二种试剂,又检验出一种物质;③ 在剩余的两只试管中分别滴入第三种试剂,检验出第三种物质;④在三次实验中都没有明显现象的是第四种物质。请回答:
(1)①中加入的试剂的名称是;
(2)②中检验出的物质是(写化学式);
(3)③中反应的现象是。