某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)
(1)写出下列物质的化学式:F ,G 。
(2)将混合物中两种金属分离开的最简单的方法是
(3)D→E的转化中,加入过量的X可能是 。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C: ;
H→I: 。
焦硫酸(H2SO4•SO3)溶于水,其中SO3都转化为硫酸。若将445 g焦硫酸溶于水配成4.00 L硫酸,该硫酸的物质的量浓度为_______________mol/L。
某有机化合物A的相对分子质量(分子量)大于100,小于110。经分析得知,其中C和H的质量分数之和为53.8%,其余为氧。请回答:
(1)1个A分子中含有_______个氧原子。
(2)已知A分子中C、H原子个数比=1:2,则该化合物的的质谱图中最大质荷比为____________。
(3)已知A可与碳酸钠溶液反应生成二氧化碳,A的核磁共振氢谱为3组峰,且面积比为6:1:1,则A的结构简式为_______________。
(1)某烃的结构简式是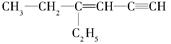 ,分子中饱和碳原子数为_____,可能在同一平面上的碳原子数最多为_________
,分子中饱和碳原子数为_____,可能在同一平面上的碳原子数最多为_________
(2)下列物质中属于同系物的是_________
①CH3CH2Cl ②CH2===CHCl ③CH3CH2CH2Cl ④CH2ClCH2Cl ⑤CH3CH2CH2CH3 ⑥CH3CH(CH3)2
| A.①② | B.①④ | C.①③ | D.⑤⑥ |
(3)咖啡酸(见下图),存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等。咖啡酸有止血作用,特别对内脏的止血效果较好。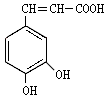
①咖啡酸与NaHCO3溶液反应的方程式。
②蜂胶的主要活性成分为CPAE,分子式为C17H16O4,该物质在一定条件下可水解生成咖啡酸和一种醇,该醇为芳香醇且分子结构中无甲基,此芳香醇的结构简式为,咖啡酸跟该芳香醇在一定条件下反应生成CPAE的化学方程式为。
1.06 g某有机物A完全燃烧,得到1.792 L(标准状况)CO2和0.90 g H2O,该有机物相对于氧气的密度为3.31
(1)该有机物的分子式为。
(2)该有机物有如下性质:①能使酸性高锰酸钾溶液褪色; ②不能与溴水发生反应 ; ③它发生硝化反应引入1个硝基时,产物只有1种硝基化合物。写出该有机物可能的结构简式:。
(6分)有的油田开采的石油中溶有一种碳氢化合物——金刚烷,它的分子立体结构如图所示:
(1)由图可知其分子式为:____________。
(2)它是由_________ 个六元环构成的六体的笼状结构。
(3)金刚烷分子的一氯代物有_______种。