在烃分子中去掉2个氢原子形成一个双键是吸热反应,大约需117kJ/mol~125kJ/mol的热量,但1,3—环己二烯失去2个氢原子变成苯是放热反应,△H=-23.4kJ/mol,以上事实表明
| A.1,3—环己二烯加氢是吸热反应 | B.苯加氢生成环己烷是吸热反应 |
| C.1,3—环己二烯比苯稳定 | D.苯比1,3—环己二烯稳定 |
合成氨反应为:N2(g)+3H2(g)  2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此
2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此 反应平衡的影响。
反应平衡的影响。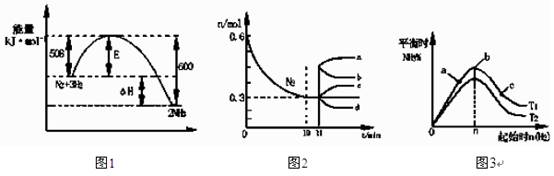
下列说法正确的是:
| A.该反应为自发反应,由图1可得加入适当的催化剂,E和△H都减小 |
| B.图2中0~10min内该反应的平均速率v(H2)=0.045mol·L-1·min-1,从11min起其 它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为d |
| C.图3中a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点 |
| D.图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2 |
Cu2O呈红色,在酸性条件下会发生自身氧化还原反应。用H2还原CuO所得产物呈红色,若要检验其中是否含有Cu2O,以下试剂选择和判断方法均正确的是:
| 选项 |
试剂 |
判断方法 |
| A |
稀硝酸 |
是否生成蓝色溶液 |
| B |
稀硫酸 |
固体物质是否完全溶解 |
| C |
浓硫酸 |
是否有无色气体生成 |
| D |
稀盐酸 |
是否生成蓝色溶液 |
下列离子方程式书写不正确的是
| A.NaOH溶液与SO2反应,当n(NaOH):n(SO2)=4:3时, 4OH- + 3SO2 = SO32-+ 2HSO3-+ H2O |
| B.CuCl2溶液与Na2S溶液2:1反应,Cu2++ S2--= CuS↓ |
| C.Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时, 2Fe2+ + 4Br- +3Cl2 =" 2" Fe3+ + 2Br2 + 6Cl- |
| D.1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积互相均匀混合: |
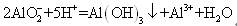
设NA为阿伏加德罗常数的值,下列说法正确的是
| A.1mol NO2与足量H2O反应,转移电子数为2mol |
| B.1mol C5H12分子中含有的共价键数目为16NA |
| C.1L 0.5mol/LNa2CO3溶液中阴离子数目小于0.5mol |
D.CO2通过Na2O2使其增重bg时,反应中转移的电子数为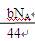 |
下列关于电解质溶液的叙述正确的是
| A.常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为、c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| B.10mL0.1mol/LNH4Cl溶液5mL0.2mol/L NaOH溶液混合:c(Na+)=c(Cl-)>c(OH-)>c(H+) |
C.相同温度和浓度的钾盐溶液中,酸式盐的p H一定小于正盐的pH H一定小于正盐的pH |
| D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 |