如下图所示的装置,C、D、E、F都是惰性电极。将电源接通后,向乙中滴入酚酞液,在F极附近显红色。试回答以下问题: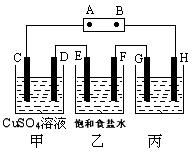
(1)电源的A极是_______;
(2)写出甲装置中电解反应的总方程式:_____ ____;
(3)如果收集乙装置中产生的气体,EF两电极产生的气体的体积比是______________;
(4)欲用丙装置给铜镀银,G应该是_______,电镀液的主要成分是_________(填化学式)。
某同学用10mol·L—1的浓盐酸配制250mL 1 mol·L—1的稀盐酸,并进行有关实验。请回答下列问题:
(1)需要量取浓盐酸mL。
(2)配制该稀盐酸时使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有
等。
(3)取所配制的稀盐酸100mL与一定质量的锌充分反应,锌全部溶解后,生成的气体在标准状况下的体积为0.896L,则参加反应的锌的质量为多少克?(写出计算过程)
(4)设反应后溶液的体积仍为100mL,则反应后溶液中H+物质的量浓度是多少?(写出计算过程)
(1)下列反应中都有水参加:
| A.Cl2+ H2O +Na2SO3="=" 2HCl + Na2SO4 |
| B.3NO2 + H2O ="=" 2HNO3 + NO↑ |
| C.NaH +H2O ="=" NaOH + H2↑ |
| D.2H2O 电解2H2↑+ O2↑ |
其中,水只是氧化剂的是,水既不是氧化剂又不是还原剂的是,(各1分)
(2)在3BrF3+5H2O=9HF+HBrO3+O2↑+Br2反应中,若有5.4gH2O被氧化,
则被还原的BrF3共mol,其中被水还原的BrF3是mol。(各2分)
海水是巨大的资源宝库。从海水中提取食盐和溴的过程如下:
 |
 (1)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br¯,其目的为富集溴元素,请写出步骤Ⅱ的化学方程式,并用双线桥法标出电子转移的方向与数目。
(1)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br¯,其目的为富集溴元素,请写出步骤Ⅱ的化学方程式,并用双线桥法标出电子转移的方向与数目。 (2)
(2) 某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如下装置简图:
某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如下装置简图: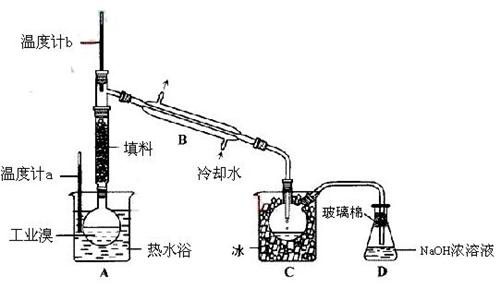

 请你参与分析讨论:
请你参与分析讨论:
 ①图中仪器B的名称: 。
①图中仪器B的名称: 。 ②
②  实验装置气密性良好,要在C中获得纯净的液溴即达到提纯溴的目的,操作中如何控制关键条件: 。
实验装置气密性良好,要在C中获得纯净的液溴即达到提纯溴的目的,操作中如何控制关键条件: 。 ③为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,则发生的反应方程式为
③为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,则发生的反应方程式为
充分反应后,再进行的分离操作是 。
一瓶溶液里可能含有OH—,Cl—,NO3—,CO32—,SO42—,五种阴离子中的某几种,现分别取溶液少许分装于两支试管里,做以下实验,并观察到相应现象如下:
(1)向第一支试管里滴入酚酞试液,溶液变红色。
(2)第二支试管里加入少量Ba(NO3)2溶液,产生白色沉淀,过滤后并将滤液移入第三支试管,向沉淀中加入稀硝酸,无变化。
(3)向第三支试管中加入足量的稀硝酸,再滴加少量AgNO3溶液,产生白色沉淀。
根据上述现象,判断溶液中肯定含有__________________离子,不含_________________离子,无法确定是否存在的离子为_______________________。
室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按下面框图进行反应。又知D溶液是黄色的,请回答:
 |
⑴A是、B是、C是(各1分)
⑵写出反应①的化学方程式、
反应现象。
(3)实验室制备B气体的化学方程式。