(1)写出氯化铁溶液中加入铁粉发生的化学方程式 。
(2)写出乙醇和乙酸在浓硫酸催化下加热反应的化学方程式 。
(8分)向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
(1)整个过程中充当还原剂的是。
(2)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果计量数是1,不用填写):
(3)把KI换成KBr,则CCl4层变为色;继续滴加氯水,CCl4层的颜色没有变化。 Cl2、HIO3、HBrO3氧化性由强到弱的顺序是。
已知乙烯能发生以下转化: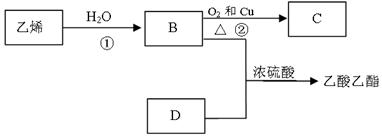
(1)乙烯的结构简式为:
(2)写出反应的化学方程式
①反应类型:
②反应类型:
(1)科学工作者为心脏病人设计的心脏起搏器使用的电池是以Pt和Zn为电极材料,依靠人体内液体中含有一定浓度的溶解氧和H+进行工作。回答下列问题:
(1)①正极材料是:,正极反应为:
②负极材料是:,负极反应为:
(2)写出下列反应的化学方程式:
①在催化剂条件下苯与液溴发生反应:
②乳酸( )与金属钠反应:
)与金属钠反应:
铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)Fe是人体不可缺少的微量元素,摄入含铁化合物可补充铁。正常人每天应补充14mg左右的铁。其中绝大部分来自于食物。如果全部通过服用含FeSO4·7H2O的片剂来补充铁,则正常人每天服需用含mg FeSO4·7H2O的片剂。
(2)某同学为了检验家中的一瓶补铁药(成分为FeSO4)是否变质,查阅了有关资料,得知Fe2+能被酸性高锰酸钾溶液氧化而使高锰酸钾溶液褪色,并结合已学的知识设计了如下实验:将药片除去糖衣研细后,溶解过滤,取滤液分别加入两支试管中,在一支试管中滴入酸性高锰酸钾溶液,在另一支试管中滴入KSCN溶液。该同学观察到的现象是:滴入酸性高锰酸钾溶液后褪色,滴入KSCN溶液后不变红,据此得出的结论是。
(3)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
3FeS2+8O2 6SO2+Fe3O4,若有3 mol FeS2参加反应,则转移mol电子。
6SO2+Fe3O4,若有3 mol FeS2参加反应,则转移mol电子。
(4)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为;
(5)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是。
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是_______________________。
(2)为防止氯气尾气污染空气,根据氯水显酸性的性质,可用溶液吸收多余的氯气,原理是(用化学方程式表示)_________________________________。根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是__________(化学式),长期露置于空气中的漂白粉,加稀盐酸后产生的气体是___________(字母代号填)。
A.O2 B.Cl2 C.CO2 D.HClO
(3)据报道,某化工总厂最近相继发生氯气泄漏和爆炸事故,当人们逃离爆炸现场时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是。
A.NaOH B.NaCl C. KBr D. Na2CO3