在一定条件下,用普通铁粉和水蒸气反应,可以得到铁的氧化物,该氧化物又可以经此反应的逆反应,生成颗粒很细的铁粉。某校化学小组利用下图所列装置进行铁与水反应的实验,并利用产物进一步与四氧化三铁反应制取铁粉。(装置中的铁架台、铁夹等必要的夹持仪器在图中均已略去)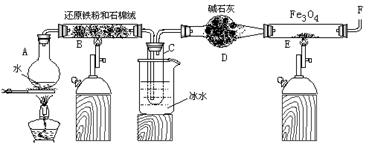
(1)烧瓶A中常加入碎瓷片,其作用是 ,B中石棉绒的作用 ,小试管C的作用是 。
(2)反应开始时先点燃 处(填A或B)酒精灯,为了安全,在E管中的反应发生前,在F出口处必须 ,E管中的反应开始后,在F出口处应 。
(3)写出高温下Fe 与H2O(g)反应的化学方程式 ,在一定条件下该反应实际上是可逆反应,试用化学平衡移动原理加以解释本实验中是如何实现Fe向Fe3O4的转变的 。
(4)停止反应,待B管冷却后,取其中固体加入过量稀盐酸,充分反应后过滤。简述证明滤液中含有Fe3+的实验操作及现象____________________________________________________。
如图所示,通电5 min后,第③极增重2.16 g,同时在A池中收集到标准状况下的气体224 mL,设A池中原混合液的体积为100 mL,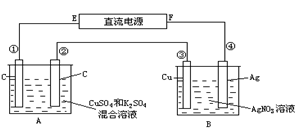
(1)求通电前A池中原混合溶液中Cu2+的物质的量浓度。
(2)求电解后A池溶液的PH
铝是最常见的金属之一。
(1)浓硝酸、浓硫酸可贮存在铝制容器的原因是。
(2)纳米铝主要应用于火箭推进剂。工业上利用无水氯化铝与氢化铝锂(LiAlH4)在有机溶剂中反应制得纳米铝,化学方程式如下:3LiAlH4+AlCl3="4Al" + 3LiCl + 6H2↑
该反应的氧化剂为。
(3)氢化铝钠(NaAlH4)是一种重要的储氢材料,已知:
NaAlH4(s)= Na3AlH6 (s)+
Na3AlH6 (s)+  Al (s) + H2(g)ΔH=+ 37 kJ·molˉ1
Al (s) + H2(g)ΔH=+ 37 kJ·molˉ1
Na3AlH6(s)="3NaH(s)+" Al (s) +  H2(g)ΔH=+ 70.5 kJ·molˉ1
H2(g)ΔH=+ 70.5 kJ·molˉ1
则NaAlH4(s)=" NaH(s)" + Al (s) + H2(g)ΔH=。
H2(g)ΔH=。
(4)已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式 存在。目前研究比较热门的Al-H2O2燃料电池,其原理如右图所示,电池总反应如下:
2Al+3HO2-+3H2O =2[Al(OH) 4]-+OH-
①正极反应式为。
②与普通锌锰干电池相比,当消耗相同质量的负极活性物质时,Al-H2O2燃料电池的理论放电量约为普通锌锰干电池的______倍。
③Al电极易被NaOH溶液化学腐蚀,这是该电池目前未能推广使用的原因之一。反应的离子方程式为。
已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2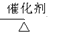 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。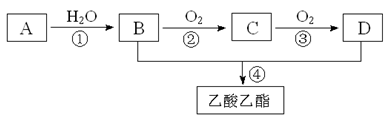
回答下列问题:
(1)写出A的电子式。
(2)B、D分子中的官能团名称分别是、。
(3)写出下列反应的反应类型:①,②,④。
(4)写出下列反应的化学方程式:
①;
② ;
④。
(5)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。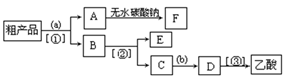
(Ⅰ)试剂a是__________,试剂b是_______________;
分离方法①是_________,分离方法②是____________,分离方法③是___________。
(Ⅱ)在得到的A中加入无水碳酸钠粉末,振荡,目的是______。
(Ⅲ)写出C → D 反应的化学方程式 。
已知有机物甲、乙、丙有如下信息:
| 甲 |
乙 |
丙 |
|
| 所含元素 |
C、H |
C、H、F |
C、H、F |
| 所含电子数 |
26 |
||
| 结构特点 |
饱和有机物 |
据此推断:
(1)甲的分子式为 ,若甲分子中有2个氢原子被F原子取代,所得的有机产物可能有 种。
(2)乙是性能优良的环保产品,可代替某些破坏臭氧层的氟利昂产品用作制冷剂。其分子中C、H、F的原子个数之比为1∶2∶2,则乙的结构简式为 。下列关于乙的叙述中正确的是 。
A. 其分子构型为正四面体型 B. 它能与溴水发生反应而褪色
C. 1 mol乙最多能与1 mol F2发生取代反应 D. 它没有同分异构
(3)将甲、乙按物质的量之比1∶1混合,所得混合物的平均摩尔质量等于丙的摩尔质量,但丙分子不存在同分异构体,则丙的分子式为 。
某相对分子质量为72的烷烃。
(1)其分子式是______________;
(2)该烷烃在空气中燃烧的化学反应方程式是;
(3)它可能的结构简式是;