Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z2+的核外电子排布式是 。
(2)在[Z(NH3)4]2+离子中,Z2+的空间轨道接受NH3分子提供的 形成配位键。
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是 。
a.稳定性:甲>乙,沸点:甲>乙
b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙
d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小到大的顺序为 (用元素符号作答)
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为 。
(6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于 。
为了减少温室气体排放,目前工业上采用CO2与H2在催化剂作用下反应制备重要化工原料CH3OH的工艺:CO2(g)+3H2(g) CH3OH(g) +H2O(g)。为了探究其反应原理进行如下实验,在2L恒容的密闭容器内250℃条件下,测得n(CO2)随时间的变化情况如下表:
CH3OH(g) +H2O(g)。为了探究其反应原理进行如下实验,在2L恒容的密闭容器内250℃条件下,测得n(CO2)随时间的变化情况如下表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(CO2)(mol) |
0.40 |
0.35 |
0.31 |
0.30 |
0.30 |
0.30 |
根据题目回答下列问题:
(1)0~3 s内用H2表示的平均反应速率是____________;
(2)平衡时CO2的转化率是____________。
(3)能说明反应已达平衡状态的是____________。
A.υ(H2)=3υ(CO2)B.容器内压强保持不变
C.υ逆(CO2)=υ正(CH3OH)D.容器内密度保持不变
(4)一定能使该反应的反应速率增大的措施有 _________。
A.及时分离出产物
B.适当降低温度
C.其他条件不变,增大CO2浓度
用系统命名方法命名下列各有机化合物
(1) (CH3)2CHCH(CH3)2 ______________________________;
(2)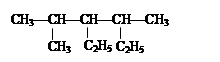 ______________________________;
______________________________;
有机物A为链烃类化合物,质谱图表明其相对分子质量为70,其相关反应如下图所示,其中A、B的结构中均含有2个—CH3,它们的核磁共振氢谱中均出现4个峰。
请回答:
(1)A的分子式为;
(2)B中所含的官能团为;C的结构简式为:
(3)I的反应类型为;
(4)写出反应Ⅰ的化学方程式:;
(5)请任写两种A的同分异构体的结构简式:
(6)A的同分异构体中有一对互为顺反异构,且结构中有2个—CH3,它们的结构简式为
和。
在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) C(mol/L) |
0 |
20 |
40 |
60 |
80 |
100 |
| C(N2O4) |
0.20 |
a |
0.10 |
c |
d |
e |
| C(NO2) |
0.00 |
0.12 |
b |
0.22 |
0.22 |
0.22 |
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅。
请回答下列问题:
(1)该反应的化学方程式为,正反应是(填“吸热”或“放热”)反应。
(2)20s时,N2O4的的浓度为mol/L,0~20s内N2O4的平均反应速率为。
(3)在80℃时该反应的平衡常数K值为(保留2位小数)。
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时。
A、N2O4的转化率越高 B、NO2的产量越大
C、N2O4与NO2的浓度之比越大 D、正反应进行的程度越大
由于NaNO2有毒,将含该物质的废水直接排放会引起水体的严重污染,所以这种废水必须经处理后才能排放。处理方法之一的原理如下:
(1)请完成并配平该化学方程式。
(2)在上述反应中,若要生成50.8 g I2,则电子转移了________个。
(3)用上述反应来处理NaNO2并不是最佳方法,其原因是
________________________________________________________________________。
从环保角度来讲,要处理NaNO2,所用物质的________(填“还原性”或“氧化性”)应该比KI更______(填“强”或“弱”)。