元素周期表中ⅣA族元素(C、Si、Ge、Sn、Pb)的单质及其化合物的用途广泛。
(1)在ⅣA族元素中,其最高价氧化物对应水化物酸性最强的是______(填化学式),简单气态氢化物沸点最低的是_____________(填化学式)。
(2)金刚砂(SiC)的晶体结构与金刚石、晶体硅类似,它们均为____晶体,其中熔沸点最低的是____(填名称)。
(3)焦炭可用于制备电石、生产水煤气等,电石的主要成分是CaC2,CaC2的电子式是___________;制备电石还需要用到CaCO3。组成CaCO3的三种元素的第一电离能按从大到小的顺序排列为____________(填元素符号)。
(4)甲硅烷(SiH4)是一种无色的液体,遇到空气能发生爆炸性自燃,生成二氧化硅固体和水。在室温下,10g SiH4燃烧放出热量446kJ,请写出其燃烧的热化学方程式: 。
(5)铅是一种金属元素,可用作蓄电池的材料,其合金可作铅字、轴承、电缆包皮之用,还可做体育运动器材铅球等。配平下列化学反应方程式,把系数以及相关物质(写化学式)填写在空格上, 并标出电子转移的方向和数目。
______PbO2+_____MnSO4+_____HNO3=___HMnO4+___Pb(NO3)2+___PbSO4↓+____
用于金属焊接的某种焊条,其药皮由大理石(CaCO3)、水泥、硅、铁等配制而成。
(1)Al的原子结构示意图为________ ___;
(2)30Si的原子的中子数为_________;
(3)可用于分离或提纯物质的方法有:①过滤 ②蒸馏 ③加热 ④分液(填序号)
除去石灰水中悬浮的大理石颗粒 。
写出下列物质的电离方程式
Na2SO4:____________________________________
Ba(OH)2:______________________________
H2SO4:_________________________________;
微粒AX2-核外有18个电子,则它的核电荷数为 ,核内中子数为 。
甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g);△H1
CH3OH(g);△H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g);△H2
CH3OH(g)+H2O(g);△H2
③CO2(g)+H2(g) CO(g)+H2O(g);△H3
CO(g)+H2O(g);△H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 |
H-H |
C-O |
CO的键能 |
H-O |
C-H |
| E/(kJ.mol-1) |
436 |
343 |
1076 |
465 |
413 |
由此计算△H1= kJ.mol-1,已知△H2=-58kJ.mol-1,则△H3= kJ.mol-1
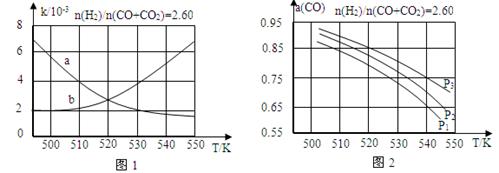
(2)反应①的化学平衡常数K的表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。
|
在一个温度和体积不变的容器中,硫可以发生如下转化,其反应过程和能量关系如图1所示。(SO2(g)+1/2O2(g) SO3(g) ΔH=-98.45kJ·mol-1)
SO3(g) ΔH=-98.45kJ·mol-1)
(1)硫燃烧的热化学方程式为:__________________。
(2)恒容条件下,下列措施中能使n(SO2)/ n(SO3)比图1所示情况减小的有____________。
| A.降低温度 | B.充入He | C.再充入1 mol SO2(g)和1 mol O2(g) | D.使用催化剂 |
(3)恒温恒容时,图1中II到III反应放出的热量比1 mol SO2和2 mol O2充分反应放出的热量__________
(填 “多”、“少”或“相等”)。
(4)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t2时引起平衡移动的条件可能是_____________;图中表示平衡混合物中SO3的含量最高的一段时间是_____________。(如t1~t2、t3~t4、t5~t6、t6~t7等)