1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度 为115~125℃,反应装置如右图。
为115~125℃,反应装置如右图。
下列对该实验的描述错误的是
A.不能用水浴加热 |
B.提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤 |
C.长玻璃管起冷凝回流作用 |
D.加入过量乙酸可以提高1-丁醇的转化率 |
下列电离方程式正确的是
A.H2S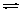 2H+ + S2- 2H+ + S2- |
B.HClO = H+ +ClO- |
C.CH3COONH4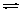 NH4+ +CH3COO- NH4+ +CH3COO- |
D.H2CO3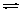 H+ + HCO3- H+ + HCO3- |
取a g某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加了a g。下列物质中不能满足上述结果的是
| A.H2 | B.CO | C.C6H12O6 | D.C2H4O |
一定温度下,某混合气体由两种有机物组成:乙炔(C2H2)和乙醛(C2H4O)。已知该气体中,碳元素的质量分数为72.0%,则氧元素的质量分数为
| A.19.6% | B.20.4% | C.28.0% | D.2.1% |
设阿伏加德罗常数的值为NA,则下列说法不正确的是
| A.15g甲基(-CH3)所含有的电子数是9NA |
| B.常温常压下,26g乙炔和苯组成的混合物中所含有的原子数为4NA |
| C.标准状况下,1L辛烷充分燃烧后生成的气态产物的分子数为8/22.4 NA |
| D.常温常压下,1molCnH2n+2所含有的共价键数目为(3n+1) NA |
(Ⅰ)1-溴丙烷与2-溴丙烷分别和氢氧化钠的醇溶液混合加热;
(Ⅱ)1-溴丙烷与2-溴丙烷分别和氢氧化钠的水溶液混合加热,则
| A.(Ⅰ)(Ⅱ)产物均相同 | B.(Ⅰ)(Ⅱ)产物均不同 |
| C.Ⅰ)产物相同,(Ⅱ)产物不同 | D.(Ⅰ)产物不同,(Ⅱ)产物相同 |