 环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮:
环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮:
 环己醇、环己酮和水的部分物理性质见下表:
环己醇、环己酮和水的部分物理性质见下表:
| 物质 |
沸点(℃) |
密度(g-cm-3,20℃) |
溶解性 |
| 环己醇 |
161.1(97.8)* |
0.9624 |
能溶于水 |
| 环己酮 |
155.6(95)* |
0.9478 |
微溶于水 |
| 水 |
100.0 |
0.9982 |
|
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点 (1)酸性Na2Cr2O7溶液氧化环己醇为放热反应,反应剧烈将导致体系温度迅速上升,副反应增多。实验中将酸性Na2Cr2O7溶液加到盛有环己醇的烧瓶中,在55-60℃进行反应。反应完成后,加入适量水,蒸馏,收集95-100℃的馏分,得到主要的含环己酮和水的混合物。
(1)酸性Na2Cr2O7溶液氧化环己醇为放热反应,反应剧烈将导致体系温度迅速上升,副反应增多。实验中将酸性Na2Cr2O7溶液加到盛有环己醇的烧瓶中,在55-60℃进行反应。反应完成后,加入适量水,蒸馏,收集95-100℃的馏分,得到主要的含环己酮和水的混合物。 ①酸性Na2Cr2O7溶液的加料方式为 。
①酸性Na2Cr2O7溶液的加料方式为 。 ②蒸馏不能分离环己酮和水的原因是 。
②蒸馏不能分离环己酮和水的原因是 。 (2)环己酮的提纯需要经过以下一系列的操作:
(2)环己酮的提纯需要经过以下一系列的操作:
a蒸馏,收集15 1-156℃的馏分;
1-156℃的馏分;
b 过滤;
c 在收集到的馏分中加NaCl固体至饱和,静置,分液;
d 加入无水MgSO4固体,除去有机物中少量水。 ①上述操作的正确顺序是 (填字母)。
①上述操作的正确顺序是 (填字母)。 ②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需 、 。
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需 、 。 ③在上述操作c中,加入NaCl固体的作用是 。
③在上述操作c中,加入NaCl固体的作用是 。 (3)利用核磁共振氢谱可以鉴定制备的产物是否为环己酮,环己酮分子中有 种不同化学环境的氢原子。
(3)利用核磁共振氢谱可以鉴定制备的产物是否为环己酮,环己酮分子中有 种不同化学环境的氢原子。
右图为实验室某浓盐酸试剂瓶标签上的有关数据,
试根据标签上的有关数据回答下列问题:
⑴该浓盐酸中HCl的物质的量浓度为 mol·L-1。 ⑵取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是。
⑵取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是。
| A.溶液中HCl的物质的量 | B.溶液的浓度 | C.溶液中Cl-的数目 | D.溶液的密度 |
用18 mol·L-1浓硫酸配制100 mL 3.0 mol·L-1稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸③溶解 ④转移、洗涤 ⑤定容、摇匀。完成下列问题:
(1)所需浓硫酸的体积是________,量取浓硫酸所用的量筒的规格是________(从下列中选用A.10 mL B.25 mL C.50 mL D.100 mL)。
(2)第③步实验的操作是__________________________ ______。
______。
(3)第⑤步实验的操作是________________________________。
(4)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”“偏小”“无影响”填写)
A.所用的浓硫酸长时间放置在密封不好的容器中________________________________
B.容量瓶用蒸馏洗涤后残留有少量的水_______C.所用过的烧杯、玻璃棒未洗涤_________
D.定容时俯视刻度线________________E.用量筒量取浓硫酸时俯视观察凹液面
( 15分)实验室用NaOH固体配制250mL 1.25mol/L的NaOH溶液,填空并请回答下列问题:
(1)配制250mL 1.25mol/L的NaOH溶液,应称取NaOH的质量_____________g
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次);
A、用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B、用天平准确称取所需的NaOH的质量,加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C、将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D、将容量瓶盖紧,颠倒摇匀
E、改用胶头滴管加水,使溶液凹面恰好与刻度相切
F、继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)溶液注入容量瓶前需恢复到室温,这是因为_____________________________;
(4)下列配制的溶液浓度偏低的是;
A、称量NaOH时,砝码错放在左盘(已移动游码)
B、向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
C、加蒸馏水时不慎超过了刻度线
D、定容时俯视刻度线
E、配制前,容量瓶中有少量蒸馏水
(5)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度线。]
A、B、C、D分别是NaNO3、NaOH、HNO3和Ba(NO3)2四种溶液中的一种,现利用另一种溶液X,用如图所示的方法可将它们依次确定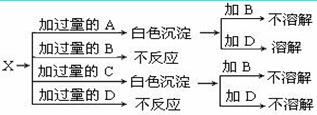
试确定A、B、C、D、X各代表何种溶液。A:______,B:______,C:_____, D:_____,X:_______。
Fe2O3和Cu2O都是常用的红色颜料。某红色粉末可能含有Fe2O3和Cu2O,某化学实验小组通过实验来探究该红色粉末的成分。已知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
(1)提出假设假设1:红色粉末只含Fe2O3;
假设2:_______________________________;
假设3:红色粉末是Fe2O3和Cu2O的混合物。
(2)初步探究: 取少量红色粉末于小烧杯中,放入足量稀硫酸,充分搅拌后粉末全部溶解(温馨提示:Cu+2Fe3+=Cu2++2Fe2+)。上述三个假设中,可能成立的是___________。
(3)进一步探究:完成后续实验方案的设计,填写下表中实验步骤、预期实验现象和结论(可不填满,也可补充)。
限选实验试剂:3 mol·L—1 H2SO4、3 mol·L—1 NaOH、0.01 mol·L—1 KMnO4、20% KSCN、3%H2O2、淀粉-KI溶液。
| 实验步骤 |
预期现象和结论 |