在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH<0,下列对图像的分析中不正确的是
CO2(g)+H2(g) ΔH<0,下列对图像的分析中不正确的是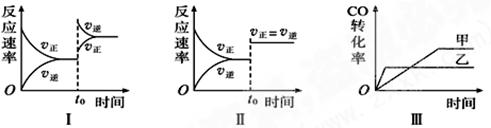
| A.图Ⅰ研究的是t0时升高温度对反应速率的影响 |
| B.图Ⅱ研究的是t0时增大压强(缩小体积)或使用催化剂对反应速率的影响 |
| C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂 |
| D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高 |
能够用来鉴别BaCl2、 NaCl 、 Na2CO3三种物质的试剂是()
| A.AgNO3溶液 | B.稀硫酸 | C.稀盐酸 | D.稀硝酸 |
下列物质中含氢原子数最多的是()
| A.2molCH4 | B.3molNH3 | C.4molH3PO4 | D.5molH2 |
下列物质中,摩尔质量最大的是()
| A.10 mL H2O | B.0.8 mol H2SO4 | C.54 g Al | D.1g CaCO3 |
下列各溶液中,Na+物质的量浓度最大的是 ( )
| A.4L0.5mol/LNaCl溶液 | B.1L0.3mol/LNa2SO4溶液 |
| C.5L0.4mol/LNaOH | D.2L0.15mol/LNa3PO4 |
某位同学配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是()
| A.所用NaOH已经潮解 |
| B.向容量瓶中加水未到刻度线 |
| C.有少量NaOH溶液残留在烧杯里 |
| D.用带游码的托盘天平称4gNaOH时误用了“左码右物”方法 |