(14分) (1)322g Na2SO4·10H2O的物质的量是________,其中所含的Na+的物质的量是 ,所含H2O分子的数目是 个;将322gNa2SO4·10H2O溶于水配成2L溶液,其物质的量浓度是_______ 。
(2)现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,则:
①该气体的物质的量为 mol。
②该气体在标准状况下的体积为 L。
③该气体溶于水后形成V L溶液,其溶液的物质的量浓度为 mol/L
对气体的转化与吸收的研究,有着实际意义。
(1)一定条件下,工业上可用CO或CO2与H2反应生成可再生能源甲醇,反应如下:
3H2(g)+CO2(g) CH3OH(g)+H2O(g)△H1=-49.0KJ/mol K1(Ⅰ)
CH3OH(g)+H2O(g)△H1=-49.0KJ/mol K1(Ⅰ)
2H2(g)+CO(g) CH3OH(g)△H2=-90.8KJ/mol K2(Ⅱ)
CH3OH(g)△H2=-90.8KJ/mol K2(Ⅱ)
则CO(g)+H2O(g) CO2(g)+H2(g)的△H3=KJ/mol和K3=(用K1和K2表示)
CO2(g)+H2(g)的△H3=KJ/mol和K3=(用K1和K2表示)
(2)在一定温度下,将0.2mol CO2和0.8mol H2充入容积为2L的密闭容器中合成CH3OH(g)。
5min达到平衡时c(H2O)=0.025mol/L,则5min内v(H2)= _______mol/(L·min)。下图图像正确且能表明该反应在第5min时一定处于平衡状态的是______。
若改变某一条件,达到新平衡后CO2的浓度增大,则下列说法正确的是_______。
a.逆反应速率一定增大 b.平衡一定向逆反应方向移动
c.平衡常数不变或减小 d.CO2的物质的量可能减小
(3)反应II可在高温时以ZnO为催化剂的条件下进行。实践证明反应体系中含少量的CO2有利于维持ZnO的量不变,原因是_________(写出相关的化学方程式并辅以必要的文字说明;已知高温下ZnO可与CO发生氧化还原反应)。
(4)实验室里C12可用NaOH溶液来吸收。室温下,若将一定量的C12缓缓通入0.2mol/L NaOH溶液中,恰好完全反应得溶液A,反应过程中水的电离程度________(填“变大”、“变小”或“不变”,下同),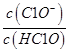 _________。溶液B为0.05mol/L的(NH4)2SO4溶液,则A、B两溶液中c(ClO-)、c(Cl-)、c(NH4+)、c(SO42-)由大到小的顺序为_________(已知:室温下HClO的电离常数Ka=3.2×10-8, NH3·H2O的电离常数Kb=1.78×10-5)。
_________。溶液B为0.05mol/L的(NH4)2SO4溶液,则A、B两溶液中c(ClO-)、c(Cl-)、c(NH4+)、c(SO42-)由大到小的顺序为_________(已知:室温下HClO的电离常数Ka=3.2×10-8, NH3·H2O的电离常数Kb=1.78×10-5)。
(选考)水是地球表面上普遍存在的化合物,我们可以用我们学习的物质结构与性质的有关知识去认识它。
(1)水的组成元素为氢和氧。氧的基态原子的价电子排布图为______________,氧的第一电离能在同周期元素中由大到小排第______位。
(2)根据杂化轨道理论,水分子中的氧原子采取的杂化形式是_______;根据价层电子对互斥理论,水分子的VSEPR模型名称为______________;根据等电子体原理,写出水合氢离子的一个等电子体(写结构式)_____________。
(3)水分子可以形成许多水合物。
①水分子可以作配体和铜离子形成水合铜离子[Cu(H2O)4]2+,1mol水合铜离子中含有σ键数目为_________。
②图是水合盐酸晶体H5O2+·Cl-中H5O2+离子的结构。
在该离子中,存在的作用力有______________。
a.配位键
b.极性键
c.非极性键
d.离子键
e.金属键
f.氢键
g.范德华力
h.π键
i.σ键
(4)韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成了“暖冰”。请从结构上解释生成暖冰的原因_________________________________。
(5)最新研究发现,水能凝结成13种类型的结晶体,除普通冰以外其余各自的冰都有自己奇特的性质:有在-30℃才凝固的超低温冰,它的坚硬程度可和钢相媲美,能抵挡炮弹轰击;有在180℃高温下依然不变的热冰;还有的冰密度比水大,号称重冰。图为冰的一种骨架形式,依此为单位向空间延伸。
①该冰中的每个水分子有_________个氢键;
②冰融化后,在液态水中,水分子之间仍保留有大量氢键将水分子联系在一起,分子间除了无规则的分布及冰结构碎片以外,一般认为还会有大量呈动态平衡的、不完整的多面体的连接方式。下图的五角十二面体是冰熔化形成的理想多面体结构。假设图中的冰熔化后的液态水全部形成下图的五角十二面体,且该多面体之间无氢键,则该冰熔化过程中氢键被破坏的百分比为________。
③如果不考虑晶体和键的类型,哪一物质的空间连接方式与这种冰连接类似?____________;
④已知O-H…O距离为295pm,列式计算此种冰晶体的密度g/cm3(已知2952=8.70×104,2953=2.57×107, =1.41,
=1.41, =1.73)。
=1.73)。
[化学――选修5:有机化学基础]添加塑化剂可改善白酒等饮料的口感,但不应超过规定的限量。DBP是一种酯类塑化剂,可由下列路线合成: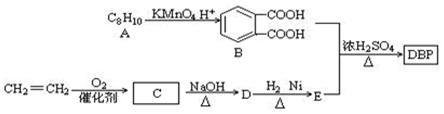
已知以下信息:
①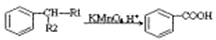
②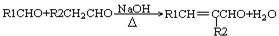 (-R1、-R2表示氢原子或烃基)
(-R1、-R2表示氢原子或烃基)
(1)A的结构简式,D的结构简式是,D→E的反应类型;
(2)D和H2 1︰1反应生成E,则E官能团名称为_________,DBP的分子式为;
(3)由B和E以物质的量比1︰2合成DBP的化学方程式:;
(4)写出2种同时符合下列条件的B的分异构体结构简式;
①能和NaHCO3溶液反应生成CO2
③能使FeC13溶液发生显色反应
②能发生银镜反应
④苯环上含碳基团处于对位
(5)写出B与碳酸氢钠溶液反应的方程式.
[化学——选修3物质结构与性质]氮的化合物在无机化工领域有着重要的地位。请回答下列问题:
(1)基态氮原子的价电子排布图为______。氮的最高价氧化物为无色晶体,它由两种离子构成:已知其阴离子构型为平面正三角形,则其阳离子的构型为形,阳离子中氮的杂化轨道类型为。
(2)某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,广泛用于陶瓷工业等领域。工业上用氮气与氧化铝和碳在一定条件下反应生成X和CO,X的晶体结构如图所示,工业制备X的化学方程式为_______。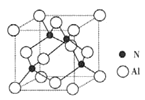
(3)X晶体中包含的化学键类型为______。(填字母标号)
| A.离子键 | B.共价键 | C.配位键 | D.金属键 |
(4)已知氮化硼与X晶体类型相同,且氮化硼的熔点比X高,可能的原因是______
(5)若X的密度为pg/cm3,则晶体中最近的两个N原子的距离为______cm(阿伏加德罗常数用NA表示,不必化简)。
[化学——选修2化学与技术]工业上常产生大量的废气、废水、废渣、废热,如果处理不好,随意排放,会造成污染,而如果科学回收,可变废为宝。
(1)一座大型硫酸厂同时又是一座能源工厂,硫酸厂生产过程中的余热若能充分回收利用,不仅不需要外界供应能源,而且还可以向外界输出大量的热能。硫酸厂产生余热的主要设备有________。
(2)硫酸厂产生的大量烧渣(硫铁矿煅烧后的灰渣)的用途是________(写一种即可);写出电解精炼铜阳极泥的一种用途________。
(3)工业制硫酸的尾气中含有的少量SO2,可先用氨水吸收,再用稀硫酸处理。
①该反应的化学方程式为_________;
②这样处理的优点是____________________。
(4)干熄焦技术是将炼焦炉推出的约1 000℃的赤热焦炭,在熄焦室中被其逆流的冷惰性气体(主要成分是氮气,温度在170~190℃)熄灭,被加热到700~800℃的惰性气体经除尘后进入余热锅炉,产生的过热蒸气送往汽轮发电机发电。干熄1 t焦炭可产生500 kg过热蒸气,可折合成46 kg标准煤。举出两例采用逆流原理的化工设备或化学仪器________、________。
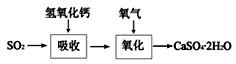
(5)下图表示石灰-石膏法吸收SO2的工艺流程,写出反应的化学方程式。