在密闭容器中进行如下反应:X2(g)+Y2(g)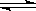 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
| A.Z为0.3mol/L | B.Y2为0.4mol/L | C.X2为0.2mol/L | D.Z为0.4mol/L |
已知1—18号元素的离子aW3+、bX+、cY2—、dZ—都具有相同的电子层结构,则下列叙述或表示方法正确的是
| A.四种元素位于同一周期 |
| B.氢化物的稳定性H2Y>HZ |
| C.离子的氧化性aW3+ > bX+ |
| D.a+3=c—2 |
苯环结构中不存在C-C单键与C=C双键的交替结构,可以作为证据的是
①苯不能使溴水反应褪色
②苯不能使酸性高锰酸钾溶液褪色
③苯在一定条件下既能发生取代反应,又能发生加成反应
④经测定,邻二甲苯只有一种结构
⑤苯是正六边形
| A.①②④⑤ | B.①③④⑤ | C.①②③④ | D.②③④⑤ |
利用如图所示装置进行下列实验,能得出相应实验结论的是
| 选项 |
① |
② |
③ |
实验结论 |
 |
| A. |
稀盐酸 |
Na2S |
漂粉精溶液 |
酸性:盐酸>氢硫酸>次氯酸 |
|
| B. |
浓盐酸 |
KMnO4 |
Na2S溶液 |
氧化性:KMnO4> Cl2>S |
|
| C. |
浓氨水 |
NaOH |
酚酞 |
碱性:NaOH >NH3·H2O |
|
| D. |
浓硫酸 |
Na2SO3 |
BaCl2溶液 |
SO2与可溶性钡盐均不反应 |
几种短周期元素的原子半径和主要化合价见下表,下列有关说法中,正确的是
| 元素符号 |
X |
Y |
Z |
L |
M |
Q |
| 原子半径/nm |
0.160 |
0.143 |
0.102 |
0.099 |
0.077 |
0.066 |
| 主要化合价 |
+2 |
+3 |
+6、-2 |
+7、﹣1 |
+4、﹣4 |
-2 |
A.离子半径大小:r(X2+)>r(Q2—)
B.Y与Q形成的化合物不能跟氢氧化钠溶液反应
C.Z的单质可在氧气中燃烧生成ZO3
D.M元素与L元素可形成一种常见的有机溶剂
欲除去下列物质中混入的少量杂质(括号内物质为杂质),错误的是
| A.乙酸乙酯(乙酸):加饱和Na2CO3溶液,充分振荡静置后,分液 |
| B.乙醇(水):加入新制生石灰,蒸馏 |
| C.溴苯(溴):加入NaOH溶液,充分振荡静置后,分液 |
| D.乙酸(乙醇):加入金属钠,蒸馏 |