250℃和1.01×10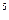 Pa时,该反应能自发进行:2
Pa时,该反应能自发进行:2 N2O5(g) = 4NO2(g) + O2(g) △H=" +56.76" kJ/mol,其自发进行的原因是 ( )
N2O5(g) = 4NO2(g) + O2(g) △H=" +56.76" kJ/mol,其自发进行的原因是 ( )
| A.是吸热反应 | B.是放热反应 |
| C.是熵减少的反应 | D.熵增大效应大于能量效应 |
向0.1mol/LNa2CO3溶液中加入下列物质或改变某一条件,不能使c(CO32—)/c(Na+)增大的是①固体碳酸钾②固体碳酸钠③固体碳酸氢钾④固体氢氧化钾⑤固体KAlO2⑥通入CO2⑦升温
| A.② | B.②③ | C.②③⑤⑥⑦ | D.⑥⑦ |
向Cr2(SO4)3的水溶液中加入氢氧化钠溶液,当pH=4.6时,开始出现Cr(OH)3沉淀。随着pH的升高沉淀增多,当pH≥13时,沉淀消失,出现亮绿色的亚铬酸根离子(CrO2—)其平衡关系如下:Cr3+(紫色)+3OH—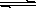 Cr(OH)3(灰绿色)
Cr(OH)3(灰绿色)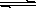 CrO2—(亮绿色)+H++H2O
CrO2—(亮绿色)+H++H2O
向0.05mol/LCr2(SO4)3的溶液50mL中加入1.0mol/L的NaOH溶液50mL,充分反应后,溶液中可观察到的现象为
| A.溶液为紫色 | B.溶液中有灰绿色沉淀 |
C.溶液为亮绿色 | D.无法判断 |
pH=5的盐酸和pH=9的氢氧化钠溶液以体积比11∶9混合,混合液的pH
| A.为7.2 | B.为8 | C.为6 | D.无法计算 |
一恒温容器用固定隔板隔成甲、乙两容器如图所示,在甲、乙两容器中分别充入3molA和4molB,反应2A(g)+B(g)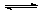 xC(g)达到平衡后,甲容器中A的浓度与乙容器中A的浓度之比为5:3,则达到平衡时甲与乙中C的体积分数为
xC(g)达到平衡后,甲容器中A的浓度与乙容器中A的浓度之比为5:3,则达到平衡时甲与乙中C的体积分数为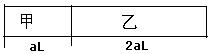
| A.甲<乙 | B.甲>乙 | C.甲<乙 | D.无法确定 |
某温度下,在一容积不变的密闭容器中,A(g)+2B(g)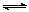 3C(g)达到平衡时,A、B、C的物质的量分别为3mol、2mol和4mol,若温度不变,向容器内的平衡混合物中再加入A、C各1mol,此时该平衡移动的方向为
3C(g)达到平衡时,A、B、C的物质的量分别为3mol、2mol和4mol,若温度不变,向容器内的平衡混合物中再加入A、C各1mol,此时该平衡移动的方向为
A.向左移动 B.向右移动 C.不移动 D.无法判断