对于某些离子的检验及结论正确的是
| A.加盐酸有无色气体产生,该气体能使澄清石灰水变混浊,原溶液中一定有CO32— |
| B.加氯化钡溶液有白色沉淀产生,再加盐酸,淀淀不消失,原溶液中一定有SO42- |
| C.加氢氧化钠溶液加热产生的气体使湿润红色石蕊试纸变蓝,原溶液中一定有NH4+ |
| D.加入NaOH后溶液中先产生白色沉淀后又消失,原溶液中一定有Mg2+ |
X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,这些单质和甲乙化合物之间存在如图所示的关系。下列说法一定正确的是
| A.X、Y、Z都是非金属单质 |
| B.X、Y、Z中至少有一种是金属单质 |
| C.若X、Y为金属单质,则Z必为非金属单质 |
| D.若X、Y为非金属单质,则Z必为金属单质 |
已知在FeCl3、CuCl2、FeCl2的混合溶液中,Fe3+、Cu2+、Fe2+的物质的量浓度之比为4:2:1,现加入适量的铁粉,使溶液中的三种离子的物质的量浓度之比为1:3:9,则投入的铁粉与原溶液中Cu2+的物质的量之比为
| A.3:5 | B.5:6 | C.5:4 | D.2:3 |
歌手那英在歌曲中唱道”雾里看花,水中望月”,其中雾属于下列分散系中( )
| A.溶液 | B.悬浊液 | C.乳浊液 | D.胶体 |
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到200 mL C(OH-)= 0.1mol/L的溶液,然后逐滴加入1 mol/L 的盐酸,测得生成沉淀的质量m与消耗盐酸的体积V关系如图所示,则下列说法正确的是 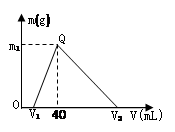
| A.原合金质量为 0.92 g |
| B.图中V2为 60 |
| C.整个加入盐酸过程中 Na+的浓度保持不变 |
| D.Q点m1为1.56 |
对下列事实的解释或说法错误的是
| A.配制一定体积的物质的量浓度溶液,定容时仰视,会使浓度偏低 |
| B.盛装水玻璃和氢氧化钠溶液的试剂瓶,都不能使用磨口玻璃塞 |
| C.向蔗糖中加入浓硫酸后出现发黑现象,说明浓H2SO4具有吸水性 |
| D.常温下,浓硝酸可用铝罐来贮存,说明浓硝酸具有强氧化性 |