(1)随着生活水平的提高,人们越来越关注营养平衡和自身的健康。
① 粮食中的淀粉在人体中水解最终转化成___________,该物质在人体内被氧化,最终生成CO2和H2O,该过程对人体健康的意义是__________________。
② 食品添加剂亚硝酸钠的外观像食盐,并有咸味,但亚硝酸钠有很强的毒性。亚硝酸钠属于______________(选填“调味剂”、“防腐剂 ”或“着色剂”)。
”或“着色剂”)。
③ 维生素C也称抗坏血酸。血液中运载氧的血红蛋白中含有Fe2+,人之所以患坏血病,是因为人体从摄取的食物中吸收的铁主要是Fe3+,Fe3+不能被人体吸收。维生素C的 主要摄入途径是______________。
( 2)中国是世界上最早研究和生产合金的国家之一。
2)中国是世界上最早研究和生产合金的国家之一。
① 在原子反应堆中得以广泛应用的钠钾合金在常温下呈液态,说明合金的熔点比其成分金属的熔点_____________。
② 铜锌合金外观和金(Au)相似,常被误认为黄金。试写出一种鉴别黄铜与黄金的化学方法___________________。铜器表面容易生成一层薄薄的铜绿[主要成份是Cu2(OH)2CO3],请写出铜在潮湿的空气发生电化学腐蚀时的负极反应式__________;用盐酸可以除去铜器表面的铜绿,该反应的化学方程式为______________________。
③ 下列对金属制品采取的防护方法不正确的是______________(填序号)。
A.在电线的外面包上一层塑料层 B.在 自行车钢圈上镀上一层金属铬
自行车钢圈上镀上一层金属铬
C.在海轮的铁制外壳上焊上铜块
(3)① CO2是目前大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。请你写出有利于降低大气中CO2浓度的一项措施________________。
② 水中含有的悬浮颗粒物等杂质,可以加入__________________等混凝剂进行净化处理,利用其溶解后形成的_______________具有吸附作用使水中的悬浮颗粒物沉降。
③ 最近,国内第一个跨区域日处理垃圾1000吨以上的垃圾焚烧发电厂在江苏投入使用。下面列出了现代生活中的常见垃圾:
A.废纸 B.废电池 C.易拉罐 D.玻璃瓶 E.塑料制品
在焚烧处理前,除废电池外,还有________________(填序号)应剔除并回收,随意丢弃电池造成的主要危害是_______________________。
已知丙二酸二乙酯能发生以下反应: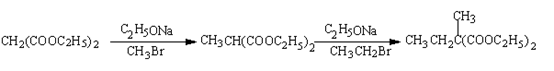
 有机物A在一定条件下可以发生如下图所示的转化(其他产物
有机物A在一定条件下可以发生如下图所示的转化(其他产物 和水已省略)。其中相关物质的结构和性质为:A不含甲基,能与金属钠反应生成氢气;B所含碳原子数与A相同,且只含有一种官能
和水已省略)。其中相关物质的结构和性质为:A不含甲基,能与金属钠反应生成氢气;B所含碳原子数与A相同,且只含有一种官能 团;C能发生银镜反应;1molD与足量碳酸氢钠溶液反应可产生二氧化碳2mol。
团;C能发生银镜反应;1molD与足量碳酸氢钠溶液反应可产生二氧化碳2mol。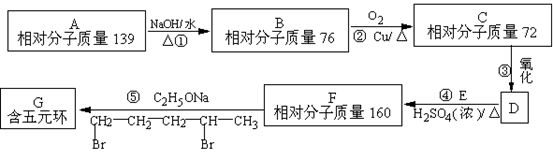
请结合图中其它信息回答下列问题:
(1)①~⑤反应中,属于取代反应的是________________(填序号)。(2)写出A、G的结构简式:A___________,G_________________(3)写出②、④反应的化学方程式: .
A是生产某新型工程塑料的基础原料之一,结构简式为: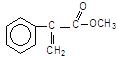
(1)写出A分子式的_____ ______
(2)拟从芳香烃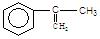 出发来合成A,其合成路线如下:
出发来合成A,其合成路线如下:
已知:A在酸性条件下水解生成有机物B和甲醇。
(a)写出⑤反应类型__________(b)写出H的结构简式__________
(c)已知F分子中含有“—CH2OH”,通过F不能有效、顺利地获得B,其原因是 ________
(d)两分子H之间发生反应生成六元环酯结构简式是:。
有机物A无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| 实验步骤 |
解释或实验结论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空: (1)A的相对分子质量为:。 |
(2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现分 别增重5.4g和13.2g。 别增重5.4g和13.2g。 |
(2)A的分子式为:。 |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 |
(3)A中含有官能团的名称:。 |
(4)A的核磁共振氢谱如下图: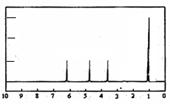 |
(4)A中含有种氢原子。 |
(5)综上所述,A的结构简式为:。 |
烃A完全燃烧生成的二氧化碳的物质的量比水的物质的量少,0. 1molA完全燃烧后的生成物全部被碱石灰吸收,使碱石灰增重26.6g。A的一溴取代产物有2种结构B1、B2。对B2进行核磁共振氢谱分析,只有一种吸收峰。请根据下图所示的各有机物之间的转化填空:
1molA完全燃烧后的生成物全部被碱石灰吸收,使碱石灰增重26.6g。A的一溴取代产物有2种结构B1、B2。对B2进行核磁共振氢谱分析,只有一种吸收峰。请根据下图所示的各有机物之间的转化填空: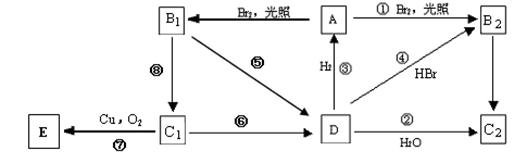
(1) 上述①~⑧反应中,属于取代反应的有_____,属于还原反应的是(填序号)。
上述①~⑧反应中,属于取代反应的有_____,属于还原反应的是(填序号)。
(2)物质C2的名称:
(3)写出①的化学方程式:
(4)写出⑤的化学方程式:
(5)D与某烷发生烷基化反应生成分子式为C 8H18的物质F,F的一卤代物只有4种,且碳链不对称。写出F的结构简式。
8H18的物质F,F的一卤代物只有4种,且碳链不对称。写出F的结构简式。
现有下列八种有机物:①乙烯、②甲苯、③溴乙烷、④乙醇、⑤苯酚、⑥乙醛、⑦乙酸、⑧乙酸乙酯。请回答:
(1)能跟银氨溶液发生银镜反应的是(填序号,下同)。
(2)能使氯化铁溶液变紫色的是。
(3)可以一步反应生成乙烯的是。
(4)能够与金属钠反应生成氢气的是。
(5)在一定条件下能跟新制氢氧化铜反应的是。