酸碱中和滴定是中学化学常见实验。
某同学欲测定某浓硫酸样品的物质的量浓度,进行了以下实验操作:
| A.冷却至室温后,在100mL容量瓶中定容配成100mL稀硫酸。 |
| B.量取20.00mL稀硫酸于锥形瓶中并滴入几滴指示剂。 |
C.将酸式滴定管和碱式滴定管 用蒸馏水洗涤干净,并用各待盛溶液润洗。 用蒸馏水洗涤干净,并用各待盛溶液润洗。 |
| D.将物质的量浓度为1.50mol·L-1标准NaOH溶液装入碱式滴定管,调节液面记下读数V1。 |
E.继续滴定至终点,记下读数为V2。
F.在锥形瓶下垫一张白纸,把锥形瓶移到碱式滴定管下小心滴入NaOH标准溶液,边滴边摇动锥形瓶。
G.量取浓硫酸样品5mL,在烧杯中用蒸馏水溶解。
H.重复以上实验。
请回答下列问题:
(1)操作步骤的顺序为 → A→ → →D→ → → H(用字母填写)。
(2)量取5mL浓硫酸的仪器是 ;量取20.00mL稀硫酸的仪器是 。
(3)选用的指示剂是 。
(4)判断到达滴定终点的现象是 。
(5)下表是实验测得的有关数据:
| 滴定 序号 |
待测稀硫酸 的体积(mL) |
所消耗NaOH标准溶液液的体积(mL) |
|
| V1 |
V2 |
||
| ① |
20.00 |
0.50 |
22.60 |
| ② |
20.00 |
6.00 |
27.90 |
请计算出该浓硫酸样品的浓度为 mol·L-1(不必写出计算过程)。
.选择下列实验方法提纯或分离下列物质,将分离方法的序号填入表格中。
| A.萃取 | B.升华 | C.蒸发 | D.分液 E.蒸馏 F.过滤 |
| 分离或提纯的物质 |
分离方法 |
| 分离BaSO4和BaCl2溶液 |
|
| 分离食盐和碘 |
|
| 分离花生油和水 |
|
| 从碘水中提取碘单质 |
|
| 用自来水制取蒸馏水 |
|
| 从溶液中获得硫酸钠晶体 |
(18分).某同学需要用到85 mL 1 mol/L的NaCl溶液,现需在实验进行配制,填空并请回答下列问题:
(1)配制1 mol/L的NaCl溶液
| 托盘天平称取NaCl的质量 |
应选用容量瓶的规格(可供选择的规格100 mL、250 mL、500 mL) |
除容量瓶外还需要的其它仪器 |
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) __ ______;
A、用30 mL水洗涤烧杯内壁和玻璃棒2—3次,洗涤液均注入容量瓶,振荡
B、用托盘天平准确称取所需NaCl的质量,将量好的NaCl倒入烧杯中,再加入少量水(约30 mL),用玻璃棒慢慢搅动,使其混合均匀
C、将NaCl沿玻璃棒注入容量瓶中
D、将容量瓶盖紧,振荡,摇匀
E、继续往容量瓶内小心加水,直到溶液凹面恰好与刻度相切
(3)指出本实验的操作错误的地方,并进行更正。
。
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”):
①若加蒸馏水时不慎超过了刻度;
②若定容时俯视刻度线___________________;
③C操作中不小心洒出有溶液。
(5)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度线一点点;
如果要除去粗盐中含有的可溶性杂质氯化钙、氯化镁和一些硫酸盐,按下表所示顺序,应加入什么试剂?完成下列表格:
| 杂质 |
加入试剂 |
化学方程式 |
| 硫酸盐 |
||
| MgCl2 |
||
| CaCl2 |
掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。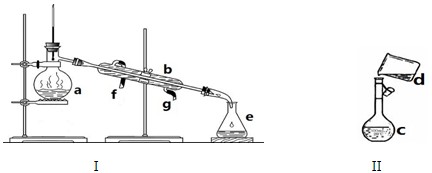
写出下列仪器的名称:
a. b. c. e
用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: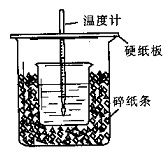
(1)从实验装置上看,图中尚缺少的一种玻璃用品是。
(2)烧杯间填满碎纸条的作用是。
(3)大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大、偏小、无影响”)
(4)如果用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等、不相等”),所求中和热(填“相等、不相等”),简述理由.
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热数值会;(填“偏大”、“偏小”、“无影响”)。