在2A + B =" 3C" + 4D的反应中,下列表示该反应速率最大的是
A.V(C)=0.5mol / (L·min)B.V(A)=0.8mol / (L·min)
C.V(B)=0.3mol / (L·min)D.V(D)=" 1mol" / (L·min)
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢或锂电池的十倍,可连续使用一个月才充一次电,其电池反应为:2CH3OH+3O2+4OH- 2CO32-+6H2O,则下列有关说法不正确的是
2CO32-+6H2O,则下列有关说法不正确的是
| A.放电时化学能转变为电能 | B.放电时CH3OH参与正极反应 |
| C.充电时阴极产生CH3OH | D.充电时每生成1mol CH3OH,则转移6mol电子 |
下列实验操作中,不能用于物质分离的是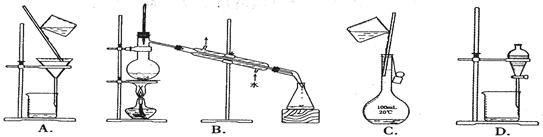
下列关于铜电极的叙述不正确的是
| A.铜锌原电池中铜是正极 |
| B.用电解法精炼铜时粗铜作阳极 |
| C.在镀件上镀铜时可用铜作阳极 |
| D.电解稀H2SO4制H2、O2时铜做阳极 |
能用酸性高锰酸钾溶液鉴别的一组物质是
| A.乙烯、乙炔 | B.苯、己烷 | C.己烷、环己烷 | D.苯、甲苯 |