下图表示4-溴-1-环己醇所发生的4个不同反应。其中产物只含有一种官能团的反应是 
| A.②③ | B.①④ | C.①②④ | D.①②③④ |
某有机物的结构如右图所示,这种有机物可能具有的性质是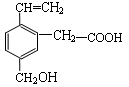
①能发生氧化反应; ②能使溴水褪色; ③能跟NaOH溶液反应;
④能发生酯化反应; ⑤能发生加成反应;⑥ 能发生银镜反应
| A.只有②④ | B.只有②③④ | C.只有①②③④⑤ | D.全部 |
下列除去括号内杂质所用的试剂和方法都正确的是
| 选项 |
物质 |
所用试剂 |
方法 |
| A |
甲烷(乙烯) |
酸性高锰酸钾溶液 |
洗气 |
| B |
乙醇(水) |
生石灰 |
分液 |
| C |
乙醇(乙酸) |
氢氧化钠溶液 |
分液 |
| D |
乙酸乙酯(乙酸) |
饱和碳酸钠溶液 |
分液 |
根据下图所示的N2(g)和O2(g)反应生成NO(g)过程中能量变化情况,判断下列说法正确的是
| A.该反应中反应物所具有的总能量高于生成物所具有的总能量 |
| B.2 mol N原子结合生成N2(g)时需要放出946 kJ能量 |
| C.1 mol NO(g)分子中的化学键断裂时需要放出632 kJ能量 |
| D.该反应的热化学方程式为:N2+O2=2NO △H=+180 kJ/mol . |
下列说法正确的是
| A.苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应 |
| B.用溴水鉴别苯和正己烷 |
| C.甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 |
| D.乙烯和苯都能使溴水褪色,褪色的原因不相同 |
下列关于电化学的说法中错误的是
| A.原电池的负极、电解池的阳极均发生氧化反应 |
| B.原电池将化学能转化为电能,电解池将电能转化为化学能 |
| C.电解水制取H2和O2时,为了增强导电性,可加入NaOH、NaCl、H2SO4 |
| D.利用原电池原理可制备化学电源,利用电解池原理可制备化学物质 |