2 g某金属加入100 ml 2 mol·L-1的硫酸溶液中,当溶液浓度降到原浓度的一半时(设溶液体积不变),金属还没反应完,该金属可能是 ( )
| A.Al | B.Zn | C.Fe | D.Mg |
根据中学化学教材所附元素周期表判断,下列叙述正确的是()
| A.由左至右第8、9、10三列元素中没有非金属元素 |
| B.第三、四、五、六周期元素的数目分别是18、18、32、32 |
| C.L电子层为奇数的所有元素都是非金属 |
| D.只有第ⅡA族元素的原子最外层有2个电子 |
有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
| 实验装置 |
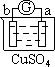 |
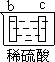 |
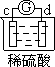 |
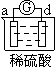 |
| 部分实验现象 |
a极质量减小 b极质量增加 |
b极有气体产生 c极无变化 |
d极溶解 c极有气体产生 |
电流计指示在导线中 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是
A.a>b>c>d B.b>c>d>a C.d>a>b>c D.a>b>d>c
一密闭容器中充人1mol N2和3mol H2,在一定条件下发生反应N2+3H2 2NH3,下列有关说法正确的是()
2NH3,下列有关说法正确的是()
| A.达到化学平衡时,正反应和逆反应的速率都为零 |
| B.当符合3u正(N2)=u正(H2)时,反应达到平衡状态 |
| C.达到化学平衡时,单位时间消耗amolN2,同时生成3amolH2 |
| D.当N2、H2、NH3的分子数比为1∶3∶2,反应达到平衡状态 |
短周期元素ZW的某种微粒的结构示意图如下,下列说法一定不正确的是()
| A.Z=a+b+c | B.若Z<a+b+c,该微粒一定是原子 |
| C.c≤b=8 | D.若c=b,该微粒可能原子或阴离子 |
下列关于化学键的说法正确的是
| A.构成单质分子的微粒一定含有共价键 |
| B.全部由非金属元素组成的化合物不一定是共价化合物 |
| C.非极性键只存在于双原子单质分子中 |
| D.不同元素组成的多原子分子里的化学键一定都是极性键 |