根据中学化学教材所附元素周期表判断,下列叙述正确的是( )
| A.由左至右第8、9、10三列元素中没有非金属元素 |
| B.第三、四、五、六周期元素的数目分别是18、18、32、32 |
| C.L电子层为奇数的所有元素都是非金属 |
| D.只有第ⅡA族元素的原子最外层有2个电子 |
当反应L(s)+aG(g)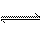 bR(g)达到平衡后,温度和压强对该反应的影响如下图所示,图中压强p1> p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断()
bR(g)达到平衡后,温度和压强对该反应的影响如下图所示,图中压强p1> p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断() 
| A.上述反应是放热反应 | B.上述反应是吸热反应 |
| C.a>b | D.d<b |
对于反应2SO2+O2 2SO3,下列判断正确的是
2SO3,下列判断正确的是
| A.2体积2SO2和足量O2反应,必定生成2体积SO3 |
| B.其他条件不变,增大压强,平衡必定向右移动 |
| C.平衡时,SO2消耗速度必定等于O2生成速度的两倍 |
| D.平衡时,SO2浓度必定等于O2浓度的两倍 |
对于反应2X(g)+Y(g) 2Z(g)不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n(Z)和反应时间t的关系如下图所示,下列判断正确的是( )
2Z(g)不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n(Z)和反应时间t的关系如下图所示,下列判断正确的是( ) 
| A.T1<T2,p1<p2,正反应为放热反应 |
| B.T1<T2,p1>p2,正反应为吸热反应 |
| C.T1>T2,p1>p2,正反应为放热反应 |
| D.T1>T2,p1<p2,正反应为吸热反应 |
溴化碘(IBr)的化学性质类似于卤素单质,能与大多数金属反应生成金属卤化物,和非金属反应生成相应的卤化物,与水反应的化学方程式为IBr+H2O====HBr+HIO,则下列关于IBr的叙述不正确的是( )
| A.IBr是共价化合物 |
| B.IBr在很多反应中是强氧化剂 |
| C.IBr跟H2O反应时既不是氧化剂也不是还原剂 |
| D.IBr跟NaOH溶液反应生成NaBrO、NaI和H2O |
标准状况下一充满氯气的试管插入水中,足够长时间后,试管内溶液液面稳定,则试管内溶液中溶质的物质的量浓度为(假设溶质不向试管外扩散)( )
| A.0.0446 mol·L-1 | B.0.0893 mol·L-1 |
| C.0.1786 mol·L-1 | D.0.0223 mol·L-1 |