300 ml某浓度的NaOH溶液中含有60 g溶质,现欲配制1 mol·L-1NaOH溶液,应取原溶液与蒸馏水的体积比约为(假设混合溶液体积为原溶液体积之和) ( )
| A.1:4 | B.1:5 | C.2:1 | D.2:3 |
PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入体积不变的2 L密闭容器中,在一定条件下发生下述反应,并于10 min时达到平衡:PCl3(g)+Cl2(g)  PCl5(g)。有关数据如下:
PCl5(g)。有关数据如下:
| PCl3(g) |
Cl2(g) |
PCl5(g) |
|
| 初始浓度/(mol/L) |
2.0 |
1.0 |
0 |
| 平衡浓度/(mol/L) |
c1 |
c2 |
0.4 |
下列判断不正确的是( )
A.10 min内,v(Cl2)=0.04 mol/(L·min)
B.当容器中Cl2为1.2 mol时,反应达到平衡
C.升高温度,反应的平衡常数减小,则平衡时PCl3的转化率变大
D.平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件下再达平衡时, c(PCl5)<0.2 mol/L
胡妥油(D)用作香料的原料,它可由A合成得到:
下列说法正确的是( )
A.若有机物A是由异戊二烯(C5H8)和丙烯酸(C3H4O2)加热得到的,则该反应的反应类型属于加成反应
B.有机物B既能跟Na反应放出H2,又能跟NaHCO3溶液反应放出CO2气体
C.有机物C的所有同分异构体中不可能有芳香族化合物存在
D.有机物D分子中所有碳原子一定共面
六种短周期元素A、B、C、D、E、F的原子序数依次增大,其中A与E同主族,B与F同主族,E与F同周期。已知常温下单质A与E的状态不同,D的核电荷数是B的最外层电子数的2倍,单质F是一种重要的半导体材料。则下列推断中正确的是( )
A.A、C两种元素可组成化学式为CA3的化合物
B.F与D形成的化合物性质很不活泼,不与任何酸反应
C.原子半径由大到小的顺序是E>F>C>D
D.元素的非金属性由强到弱的顺序是D>C>F>B
下列图示与对应的叙述相符的是( )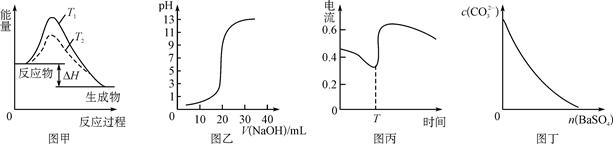
| A.图甲表示温度T1>T2,SO2与O2反应过程中的能量变化 |
| B.图乙表示0.100 0 mol/L NaOH溶液滴定20.00 mL 0.100 0 mol/L CH3COOH溶液所得到的滴定曲线 |
| C.图丙表示Zn、Cu和稀硫酸构成的原电池在工作过程中电流强度的变化,T时加入了H2O2 |
D.图丁表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO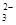 )的浓度变化 )的浓度变化 |
下列离子或分子组中能大量共存且满足相应要求的是( )
| 选项 |
离子 |
要求 |
| A |
K+、AlO 、Cl-、MnO 、Cl-、MnO |
c(K+)<c(Cl-) |
| B |
Fe3+、NO 、I-、HCO 、I-、HCO |
逐滴滴加盐酸立即有气体产生 |
| C |
NH 、Al3+、SO 、Al3+、SO 、CH3COOH 、CH3COOH |
滴加NaOH溶液立刻有气体产生 |
| D |
Na+、Cu2+、Cl-、SO |
逐滴滴加氨水先有沉淀产生,后沉淀消失 |