已知C2H4(g)和C2H5OH(1)的燃烧热分别是-1411.0kJ·mol-1和-1366.8kJ mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为
| A.-44.2 kJ·mol-1 | B.+44.2 kJ·mol-1 编号 起始状态(mol) 平衡时HBr(g) 物质的量(mol) |
| C.-330 kJ·mol-1 | D.+330 kJ·mol-1 |
分别将下列物质:①CuSO4 ②Na2O2 ③NaCl ④Ca(HCO3)2 ⑤FeCl3投入水中,对其溶液加热蒸干,仍能得到原物质的是 ( )
| A.①②③ | B.①③ | C.③④ | D.③ |
同时对农作物施用含N、P、K的三种化肥,对给定的下列化肥①K2CO3、②KCl、③Ca(H2PO4)2、④(NH4)2SO4、⑤氨水,最适当的组合是( )
| A.①③④ | B.①③⑤ | C.②③④ | D.②③⑤ |
为了配制NH4+浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入①适量的HCl②适量的NaCl③适量的氨水④适量的NaOH,正确的是( )
| A.①② | B.③ | C.③④ | D.④ |
FeCl3的水解方程式可写为FeCl3+3H2O 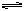 Fe(OH)3+3HCl,若提高水解程度采取的方法是 ( )
Fe(OH)3+3HCl,若提高水解程度采取的方法是 ( )
| A.降低温度 | B.加入少量Na2CO3 | C.加入少量盐酸 | D.增加FeCl3的浓度 |
关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液。下列说法不正确的是
A.c(NH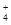 );③>① );③>① |
| B.水电离出的c(H+):②>① |
| C.①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O) |
D.①和③等体积混合后的溶液:c(NH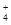 )>c(Cl-)>c(OH-)>c(H+) )>c(Cl-)>c(OH-)>c(H+) |