煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知:CO(g)+H2O(g) 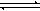 CO2(g)+H2(g)的平衡常数随温度的变化如下表:
CO2(g)+H2(g)的平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
830 |
1000 |
| 平衡常数K |
10 |
9 |
1 |
0.6 |
试回答下列问题
(1)上述反应的正反应是 反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率 (填“增大”、“减小”或“不变”),容器内混合气体的压强 (填“增大”、“减小”或“不变”)。
(3)830℃,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有 (选填A、B、C、D)。
| |
A |
B |
C |
D |
n(CO2 ) ) |
3 |
1 |
0 |
1 |
| n(H2) |
2 |
1 |
0 |
1 |
| n(CO) |
1 |
2 |
3 |
0.5 |
| n(H2O) |
5 |
2 |
3 |
2 |
(4)830℃时,在2L的密闭容器中加入4molCO(g)和6molH2O(g)达到平衡时,CO的转化率是 。
写出下列反应的离子方程式
(1)过氧化钠与水
(2)金属铝与稀硫酸溶液
(3)向Na2CO3与NaHCO3混和溶液加入CaCl2溶液
(4)Al和Na的单质同时加入到一定量的水中,充分反应后,发现既无沉淀生成又无固体残留物存在,请用两个离子方程式表示有关生成H2的变化:
(A)
(B)
(5)把铜片放入稀硝酸中: ;
(1)下列物质:①H2O②石墨③Na2SO4④硫酸⑤CH3COOH⑥蔗糖,属于强电解质的是;属于弱电解质的是;属于非电解质的是(用编号填写)。
(2)在下列的空白处填写最适宜的除杂试剂或方法
①小苏打溶液中含少量苏打_______
②苏打固体中含少量小苏打_________
③CO2气体中混有少量的HCl气体________
等质量的CO和CO2,物质的量之比为;氧原子个数之比为;同温同压下,CO和CO2的密度之比为,体积之比为
(6分) 现有A、B、C、D、E、F、G六种物质,已知,A、B、C、D是气体,A是密度最小的气体,B在通常情况下呈黄绿色,把四种气体分别通入酸性硝酸银溶液中,通入B、D气体时立即出现白色沉淀,纯净的A可以在B中安静地燃烧,发出苍白色的火焰并生成D。把无色无刺激性气味气体C通入澄清石灰水时变浑浊。E为常见的金属单质,其与D的水溶液发生反应产生A和F,F中通入B气体可以得到G
(1)D、F的化学式分别为:
D______________________ F_____________________
(2) C的电子式为。
(3) B与F生成G的离子方程式为________________________________
(4) C与澄清石灰水反应的离子方程式为。
(5)实验室用KSCN检验G中阳离子,现象是________________________
(1)现有下列五种物质:(a)食盐(b)食醋(c)苹果汁(d)葡萄糖(e)青霉素,请按下列要求填空(填序号)。
富含维生素C的是;可直接进入血液补充能量的是;应用最广泛的抗生素之一的是;即可作为调味剂,又可预防感冒的是;食用过多会引起血压升高、肾脏受损的。
(2)防治环境污染,改善生态环境已成为全球的共识。
①空气质量报告的各项指标可以反映出各地空气的质量。下列气体已纳入我国空气质量报告的是(填字母)。
a.CO2 b.N2 c.NO2
②垃圾应分类收集。导致“白色污染”的生活垃圾应放置于贴有(填字母)标志的垃圾筒内。
③工业废水需处理达标后才能排放。下列废水处理的方法合理的是(填字母)。
a.用中和法除去废水中的酸
b.用混凝剂除去废水中的重金属离子
c.用氯气除去废水中的悬浮物
(3)材料是人类赖以生存的重要物质基础,而化学是材料科学发展的基础。请填写下列空格。
①生活中的陶瓷、水泥和______________属于传统无机硅酸盐材料,其中生产不需要用石灰石作原料的是___________。
②在原子反应堆中得以广泛应用的钠钾合金在常温下呈液态,说明合金的熔点比其成分金属的熔点(填“高”或“低”)。
③下列对金属制品采取的防护方法不正确的是(填序号)。
A.在电线的外面包上一层塑料层 B.在自行车钢圈上镀上一层金属铬
C.在海轮的铁制外壳上焊上铜块
(4)某肉制品包装上印有相关配料:精选瘦肉、食盐、亚硝酸钠、苯甲酸钠。其中属于调味剂的是_______,属于发色剂的是_______,属于防腐剂的是__________。