能正确表示下列反应的离子方程式是
A.将铜屑加入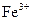 溶液中:2Fe3+ + Cu ="2" Fe2+ + Cu2+ 溶液中:2Fe3+ + Cu ="2" Fe2+ + Cu2+ |
B.将磁性氧化铁溶于盐酸:Fe3O4 + 8H+ = 3Fe3+ + 4H2O = 3Fe3+ + 4H2O |
| C.将氯化亚铁溶液和稀硝酸混合:Fe2+ + 4H+ + NO3— = Fe3+ + 2H2O + NO↑ |
| D.将铁粉加入稀硫酸中:2Fe + 6H+ + = Fe3+ + 3H2↑ |
已知某可逆反应 mA(g)+ nB(g) pC(g),在密闭容器中进行,下图表示在 不同反应时间 t、温度 T 和压强 P 与反应物 B 在混合气体中的百分含量 B%的关系曲线,由曲线分析,下列判断正确的是()
pC(g),在密闭容器中进行,下图表示在 不同反应时间 t、温度 T 和压强 P 与反应物 B 在混合气体中的百分含量 B%的关系曲线,由曲线分析,下列判断正确的是()
| A.T1<T2、P1>P2、m+n>p,△H <0; |
| B.T1>T2、P1<P2、m+n>p,△H >0; |
| C.T1>T2、P1<P2、m+n<p,△H >0; |
| D.T1<T2、P1>P2、m+n<p,△H <0; |
常温下下列各组离子在指定溶液中能大量共存的是()
| A.pH=1 的溶液中:Fe2+、NO-3、SO24-、Na+ |
| B.由水电离出的 c(H+)=1×10-14mol/L 的溶液中:Ca2+、Cl-、HCO-3、K+ |
| C.c(H+)/c(OH-)=1×1012的溶液中:NH+4、Cl-、NO-3、Al3+ |
| D.c(Fe3+)=0.1mol/L 的溶液中:K+、ClO-、SO42-、SCN- |
在一密闭容器中进行如下反应:3H2(气)+N2(气) 2NH3(气),已知反应过程中某一时 刻 H2、N2、NH3的浓度分别为 0.3mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是()
2NH3(气),已知反应过程中某一时 刻 H2、N2、NH3的浓度分别为 0.3mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是()
| A.H2为 0.6mol/L、N2为 0. 2mol/L | B.NH3为 0.25mol/L |
| C.N2、NH3均为 0.15mol/L | D.NH3为 0.4mol/L |
已知热化学方程式:2SO2(g)+O2(g) 2SO3(g); H=-Q kJ·mol-1(Q>0)。下列说法 正确的是( )
2SO3(g); H=-Q kJ·mol-1(Q>0)。下列说法 正确的是( )
| A.相同条件下,2 mol SO2(g)和 1 mol O2(g)所具有的能量小于 2 mol SO3(g)所具有的能量 |
| B.将 2 mol SO2(g)和 1 mol O2(g)置于一密闭容器中充分反应后,放出热量为 Q kJ |
| C.增大压强或升高温度,该平衡都向逆反应方向移动 |
| D.如将一定量 SO2(g)和 O2(g)置于某密闭容器中充分反应放热 Q kJ,则此过程中有 2 mol SO2(g)被氧化 |
下列各组实验中溶液最先变浑浊的是()
| A.0.1mol/LNa2S2O3和 H2SO4 各 5mL,加水 5mL,反应温度10℃ |
| B.0.1mol/LNa2S2O3 和 H2SO4各 5mL,加水 10mL,反应温度 10℃ |
| C.0.1mol/L Na2S2O3和H2SO4各 5mL,加水 5mL,反应温度 30℃ |
| D.0.2mol/L Na2S2O3和H2SO4各 5mL,加水 10mL,反应温度 30℃ |