下列实验中,合理的是
| A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
B.用100mL 量 筒量取5.20mL 盐酸 筒量取5.20mL 盐酸 |
| C.用托盘天平称取25.20g NaCl固体 |
| D.用100mL 容量瓶配制125mL 0.1mol·L-1盐酸 |
化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应中属于这种情况的是:①过量的锌与18 mol·L-1的硫酸反应;②过量的氢气与少量氮气在催化剂存在下充分反应;③浓盐酸与过量的MnO2反应;④过量铜与浓硫酸反应;⑤过量稀硝酸与银反应;⑥过量稀硫酸与块状石灰石反应
| A.②③⑤ | B.②③④⑥ |
| C.①④⑤ | D.①②③④⑤⑥ |
下列有关能量的判断或表示方法正确的是
| A.从C(石墨)=C(金刚石)ΔH=+1.9 kJ·mol-1,可知石墨比金刚石更稳定 |
| B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 |
| C.由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则向含0.1 mol HCl的盐酸中加入4.0 gNaOH固体,放出热量等于5.73 kJ |
| D.2 gH2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为: 2H2(g)+O2(g)=2H2O(l) ΔH=-285.8 kJ·mol-1 |
下列有关实验现象和解释或结论都正确的是
| 选项 |
实验操作 |
实验现象 |
解释或结论 |
| A |
将充满NO2的密闭玻璃球浸泡在热水中 |
红棕色变深 |
反应2NO2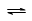 N2O4的 N2O4的△H<0 |
| B |
将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡 |
下层分别呈无色和紫红色 |
还原性:I- >Br- >Fe2+ |
| C |
某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水 |
有白色沉淀出现 |
该钾盐是K2CO3 |
| D |
把SO2通入紫色石蕊试液中 |
紫色褪去 |
SO2具有漂白性 |
在恒容密闭容器中,一定条件下进行如下反应:NO(g)+CO(g)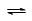
 N2(g)+CO2(g);△H=-373.2kJ·mol-1 ,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g);△H=-373.2kJ·mol-1 ,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
| A.加催化剂同时升高温度 |
| B.加催化剂同时增大压强 |
| C.温度不变同时充入Ar |
| D.降低温度同时增大压强 |
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下图转化关系。下列有关物质的推断正确的是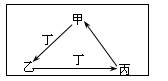
| A.若甲为焦炭,则丁可能是O2 |
| B.若甲为Fe,则丁可能是Cl2 |
| C.若甲为AlCl3,则丁可能是NH3 |
| D.若甲为NaHCO3,则丁可能是HCl |