恒温恒压下,在一个可变容积的容器中发生如下反应: A(g) + B(g) 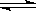 C(g)
C(g)
(1)若开始时放入1molA和1molB,达到平衡后,生成amolC,这时A的物质的
量为 mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol
(3)若开始时放入xmolA、2molB和1molC,到达平衡后,C的物质的量是3amol,x= mol.
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量是  mol.
mol.
有浓度为0.1 mol•L-1的盐酸、硫酸、醋酸三种溶液,试回答:
(1)三种溶液中c(H+) 依次为a mol·L-1,b mol·L-1,c mol·L-1,其大小顺序为__________。
(2)等体积的以上三种酸分别与过量的NaOH 溶液反应,生成的盐的物质的量依次为
n 1mol,n2 mol,n3 mol,它们的大小关系为____________。
(3)中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次是V1L、V2L、V3L,其大小关系为____________。
(4)与锌反应时产生氢(气)的速率分别为v1、v2、v3,其大小关系为____________。
若以铁棒、碳棒、导线和氯化铁溶液为用品设计原电池。电池反应式为_________________________。
某温度(t℃)时,水的KW=10-13则该温度(填大于、等于或小于)______25℃,理由是________________________________________________
依据氧化还原反应:2Ag+(aq) + Cu(s) ="=" Cu2+(aq) + 2Ag(s)设计的原电池如图所示。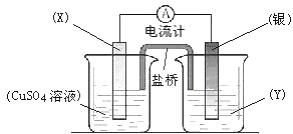
请回答下列问题:
(1)电极X的材料是_________;电解质溶液Y是_________;
(2)银电极为电池的_________极,发生的电极反应为________________________;X电极上发生的电极反应为___________________________;
(3)外电路中的电子是从_________电极流向_________电极。
A和B反应生成C,假定反应由A、B开始,它们的起始浓度均为1 mol•L-1。反应进行2min后A的浓度为0.8 mol•L-1,B的浓度为0.6 mol•L-1,C的浓度为0.6 mol•L-1。则2min内反应的平均速率v(A)=____________,v(B)=_________________,v(C)=_______________。该反应的化学反应方程式为:______________________________。