向两支分别盛有0.1mol/L醋酸和饱和硼酸(H3BO3)溶液的试管中滴加等浓度碳酸钠溶液,实验现象为(1) 三种酸由强到弱的顺序是(用化学式表示)(2) ,]硼酸(H3BO3)在食品、医药领域应用广泛。
(3) 请完成B2H6气体与水反应的化学方程式:B2H6 +6H2O=2H3BO3 +________。
(4) 在其他条件相同时,反应H3BO3 +3CH3OH  B(OCH3)3 +3H2O中,H3BO3的转化率(
B(OCH3)3 +3H2O中,H3BO3的转化率( )在不同温度下随反应时间(t)的变化见下图,由此图可得出:
)在不同温度下随反应时间(t)的变化见下图,由此图可得出:
①温度对应该反应的反应速率和平衡移动的影响是____ ___
②该反应的 _____0(填“<”、“=”或“>”).
_____0(填“<”、“=”或“>”).
(5) H3BO 3溶液中存在如下反应: H3BO 3(aq)+H2O(l) [B(OH)4]-( aq)+H+(aq)
[B(OH)4]-( aq)+H+(aq)
已知0.70 mol·L-1 H3BO 3溶液中,上述反应于298K达到平衡时,c平衡(H+)="2." 0 × 10-5mol·L-1,c平衡(H3BO 3)≈c起始(H3BO 3),水的电离可忽略不计,此温度下该反应的平衡常数K= ,
(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)
第三代混合动力车,可以用电动机、内燃机或二者结合作为动力。汽车在刹车或下坡时,
电池处于充电状态。混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。下图是镍氢电池充放电原理的示意,其总反应式为: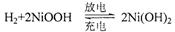 ,下列说法中正确的是
,下列说法中正确的是
| A.混合动力车上坡或加速时,溶液中的OH-向乙电极移动 |
| B.混合动力车刹车或下坡时,乙电极周围溶液的pH增大 |
| C.混合动力车上坡或加速时,乙电极电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH- |
| D.混合动力车刹车或下坡时,甲电极电极反应式为H2+2OH-+2e- =2H2O |
根据下列化学实验示意图及表中实验现象,能得出正确结论的是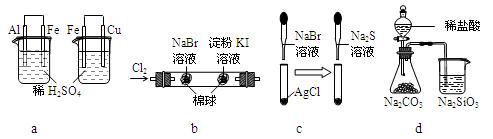
| 选项 |
实验 |
实验现象 |
结论 |
| A |
a |
左烧杯中铁表面有气泡,右烧杯中铜表面有气泡 |
活动性:Al>Fe>Cu |
| B |
b |
左边棉花变为橙色,右边棉花变为蓝色 |
氧化性:Cl2>Br2>I2 |
| C |
c |
白色固体先变为淡黄色,后变为黑色 |
溶解性:AgCl < AgBr< Ag2S |
| D |
d |
锥形瓶中有气体产生,烧杯中液体变浑浊 |
非金属性:Cl>C>Si |
有X、Y、Z、W、M五种短周期元素,其中X、 Y、Z、W同周期, Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2-
>W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法正确的是
| A.X、M两种元素只能形成X2M型化合物 |
| B.Y、Z两元素的气态氢化物中,Y的气态氢化物更稳定 |
| C.Z、W两元素的最高价氧化物对应水化物的酸性:Z > W |
| D.W、M两元素的某些单质或化合物可作为自来水消毒剂 |
已知A、B、C、D、E分别为Ca(OH)2、Ca (HCO3)2、HCl、Ba(NO3)2、Na2CO3五种溶液中的一种。现将它们相互反应情况列表如下(表中“↓”表示生成沉淀;“↑”表示生成气体; “—”表示无现象)据此可判断C是
(HCO3)2、HCl、Ba(NO3)2、Na2CO3五种溶液中的一种。现将它们相互反应情况列表如下(表中“↓”表示生成沉淀;“↑”表示生成气体; “—”表示无现象)据此可判断C是
A.HClB.Ca(HCO3)2C.Na2CO3D.Ba(NO3)2
某温度下,将Fe(OH)3(s)、Cu(OH)2(s) 分别置于蒸馏水中达到沉淀溶解平衡后,金属阳离子浓度随溶液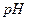 的变化如图所示。下列判断正确的是
的变化如图所示。下列判断正确的是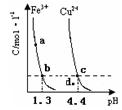
A.加适量浓NH3·H2O可使溶液由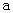 点变到 点变到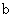 点 点 |
B.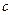 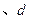 两点代表的溶液中 两点代表的溶液中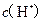 与 与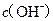 乘积不相等 乘积不相等 |
C.Cu(OH)2在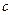 点比在d点代表的溶液中溶解程度小 点比在d点代表的溶液中溶解程度小 |
D.该温度下,氢氧化铁的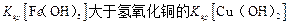 |