单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硫、磷等杂质),粗硅与氯气反应生 成四氯化硅(反应温度450-500°C),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置
成四氯化硅(反应温度450-500°C),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置 示意图。
示意图。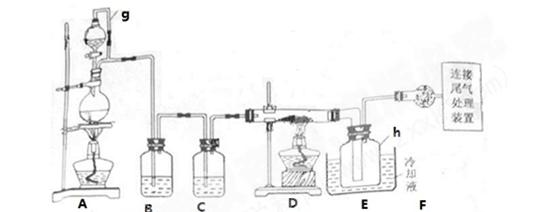
相关信息如下: a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物质 |
SiCl4 |
BCl3 |
AlCl3 |
FeCl3 |
PCl5 |
| 沸点/℃ |
57.7 |
12.8 |
—— |
315 |
—— |
| 熔点/℃ |
-70.0 |
-107.2 |
—— |
—— |
—— |
| 升华温度/℃ |
—— |
—— |
180 |
300 |
162 |
请回答下列问题:
(1)写出四氯化硅水解方程式 。
(2)装置A中g管的作用是 ;装置C中的试剂是 ;装置E中的h瓶需要冷却理由是 。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是: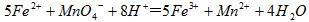
①滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。
②某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml试样溶液,用1.000×10-2mol· L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是 。
用18.4mol·L-1的浓硫酸,配制 100 ml 1.0 mol·L-1的稀硫酸,请回答以下问题:
(1)需要18.4mol·L-1的浓硫酸ml。
(2)下列哪组仪器在配制时不需要用到 ()
①托盘天平②分液漏斗③250ml容量瓶④烧杯⑤胶头滴管
⑥量筒⑦玻璃棒⑧铁架台(带铁夹)⑨100ml容量瓶
A.③④⑤⑦⑨ B.①②⑤⑥⑧ C.①②③⑧ D.③④⑤⑥
(3)下列实验步骤中,正确的操作顺序应该是:
A 用量筒量取浓硫酸,缓缓倒入装有约50ml蒸馏水的烧杯里,并用玻璃棒搅拌。
B 用约30ml蒸馏水,分出三次洗涤烧杯和玻璃棒,将每次洗涤液都倒入容量瓶中;
C 将稀释后的硫酸小心地倒入容量瓶中;
D.检查100ml容量瓶瓶口是否有漏液现象;
E.将蒸馏水直接加入容量瓶,至液面接近刻度线1——2cm处;
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液;
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,至液面最低点与刻度线相切;
(4)进行A步骤操作的时候,应该选用
①10 ml量筒②50 ml量筒③5000 ml量筒④1000 ml量筒
(5)进行A步操作后,必须后,才能进行C步操作。
(14分)紫菜与海带类似,是一种富含生物碘的海洋植物。商品紫菜轻薄松脆、比海带更易被焙烧成灰实验室里从紫菜中提取碘的流程如下图: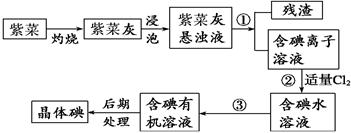
(1)实验室焙烧紫菜,需要下列仪器中的________(填序号)。
a.试管 b.烧杯 c.坩埚 d.泥三角 e.铁三脚架 f.酒精灯
(2)指出提取碘的过程中有关的实验操作名称:①________,③__________。
(3)提取碘的过程中,可选择的有机试剂是 ( )
| A.酒精 | B.苯 | C.乙酸 | D.食盐水 |
选择该试剂的理由是。
(4)为使紫菜灰中碘离子转化为碘的有机溶液,实验室有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器有______________、________________。
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,观察下面实验装置图改正其中的错误之处: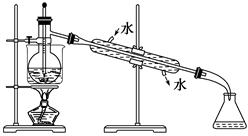
①_________________________________________;
②_________________________________________;
③_________________________________________。
(6)进行上述蒸馏操作时,使用水浴加热,最后晶态碘在里聚集。
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用来消
毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,欲准确测定过氧化
氢的含量。请填写下列空白:
(1)取10.00 mL密度为ρg/mL的过氧化氢溶液稀释至250mL。移取稀释后的过氧化
氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式为。
(3)滴定时,将高锰酸钾标准溶液注入(填“酸式”或“碱式”)滴定管
中,滴定到达终点的现象是。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中
过氧化氢的质量分数为。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果(填“偏高”或“偏低”或“不变”)。
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用来消
毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,欲准确测定过氧化
氢的含量。请填写下列空白:
(1)取10.00 mL密度为ρg/mL的过氧化氢溶液稀释至250mL。移取稀释后的过氧化
氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式为。
(3)滴定时,将高锰酸钾标准溶液注入(填“酸式”或“碱式”)滴定管
中,滴定到达终点的现象是。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中
过氧化氢的质量分数为。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果(填“偏高”或“偏低”或“不变”)。
已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
主要实验步骤如下:①按图组装仪器,并检查装置的气密性
②将ag试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量,得到bg
④从分液漏斗滴入6mol·L-1的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U型管的质量,得到cg
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为dg
请填空和回答问题:
(1)试剂C的名称为:;
(2)装置中干燥管B的作用是;
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果(填偏高、偏低或不变)
(4)步骤⑤的目的是;
(5)该试样中纯碱的质量分数的计算式为;
(6)还可以用其他实验方法测定试样中纯碱的质量分数。请简述一种不同的实验法。