(14分)通过沉淀-氧化法处理含铬废水,减少废液排放对环境的污染,同时回收K2Cr2O7。实验室对含铬废液(含有Cr3+、Fe3+、K+、SO42-、NO3-和少量Cr2O72-)回收与再利用工艺如下:
已知:①Cr(OH)3 + OH- ="=" CrO2- + 2H2O;②2CrO2- + 3H2O2 + 2OH- ="=" 2CrO42- + 4H2O;
③H2O2在酸性条件下具有还原性,能将+6价Cr还原为+3价Cr。
(1)实验中所用KOH浓度为6 mol·L-1,现用KOH固体配制250mL 6 mol·L-1 的KOH溶液,除烧杯、玻璃棒外,还必需用到的玻璃仪器有 。
(2)抽滤过程中要及时观察吸滤瓶内液面高度,当快达到支管口位置时应进行的操作为 。
(3)滤液Ⅰ酸化前,进行加热的目的是 。冰浴、过滤后,应用少量冷水洗涤K2Cr2O7,其目的是 。
(4)下表是相关物质的溶解度数据:
| 物质 |
0℃ |
20℃ |
40℃ |
60℃ |
80℃ |
100℃ |
| KCl |
28.0 |
34.2 |
40.1 |
45.8 |
51.3 |
56.3 |
| K2SO4 |
7.4 |
11.1 |
14.8 |
18.2 |
21.4 |
24.1 |
| K2Cr2O7 |
4.7 |
12.3 |
26.3 |
45.6 |
73.0 |
102.0 |
| KNO3 |
13.9 |
31.6 |
61.3 |
106 |
167 |
246.0 |
根据溶解度数据,操作Ⅰ具体操作步骤为① 、② 。
(5)称取产品重铬酸钾试样2.000g配成250mL溶液,取出25.00mL于锥形瓶中,加入10mL 2mol/LH2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200 mol·L-1Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①若实验中共用去Na2S2O3标准溶液30.00mL,所得产品的中重铬酸钾的纯度为 (设整个过程中其它杂质不参与反应)。
②若滴定管在使用前未用Na2S2O3标准溶液润洗,测得的重铬酸钾的纯度将 (填“偏高”、“偏低”或“不变”)。
有甲、乙两位同学根据所学化学知识,设计了由铜和硫酸为原料制取硫酸铜的两种方案:①铜与浓硫酸加热直接反应,即Cu→CuS04
②将铜加到热的稀硫酸中并通入空气来制备硫酸铜,即由Cu→CuO→CuSO4,
试回答:
(1)、写出方案①的化学反应方程式
这两种方案,你认为哪一种方案比较合理?。(答编号),理由是
(2)、实验室采用方案①取6.4 g铜片和10 mL 18 mol·L-1浓硫酸,放在试管中共热时发现,铜与热的浓硫酸反应后并没有得到预期的蓝色溶液,而是在试管底部看到灰白色沉淀。甲、乙两位同学为了验证其中灰白色沉淀的主要成分,设计下列实验:
实验步骤:倾倒掉上层液体后,向所得灰白色的固体中加入适量蒸馏水,边加边搅拌
实验现象:_____________________________________________
实验结论:所得灰白色固体的化学式为________
直到最后反应完毕,发现试管中还有铜片剩余。可两位同学仍然认为试管中还有硫酸剩余,他们这样认为的理由是________________
为探索乙醇氧化的反应机理,某研究性学习小组的学生设计了下列实验方案。
(1) 将一根粗铜丝绕成螺旋状,称量得到数值m1 g ;
(2) 取一支试管,加入3 mL 乙醇;
(3) 把上述已称量过的铜丝放在酒精灯火焰上加热至红热后稍冷,可看到铜丝___________
_______________________________(填写现象),称量得到数值 m2 g,并且m2_____ m1 (填“大于”、“小于”或“等于”)
(4) 将冷却后的铜丝伸入试管里的酒精溶液中,可看到铜丝________________________(填写现象)
(5) 若将红热的铜丝伸入试管里的酒精溶液中,可看到铜丝________________________(填写现象)
(6) 反复多次后,可闻到试管里溶液有____________________________________________;
(7) 最后将从酒精溶液中取出的铜丝烘干后称量,得到数值 m3 ,则m3_____________ m1(填“大于”、“小于”或“等于”)
(8) 步骤(3)中的化学反应方程式为_____________________________,步骤(5)中的化学方程式为_____________________,总的反应方程式为___________________________。
实验室制乙烯时因使用的试剂浓硫酸既有强脱水性,又有强氧化性,在加热条件下,乙醇很有可能与浓硫酸参加反应,生成二氧化碳、二氧化硫、水蒸气、炭。该副反应的化学方程式是:_________________________________有同学设计了如下三个方案检验,检验二氧化碳、二氧化硫、水蒸气这三种物质的存在,请评价是否可行?
方案一:
方案二:
方案三:
你认为合理的设计方案应怎样?
某同学用下图所示装置制取乙烯,请回答: 
(1)在装置①~③中,有明显错误的一个装置是_____(填序号)。
(2)实验室制取乙烯的化学方程式为。
(3)若装置②中所盛试剂为氢氧化钠溶液,则其作用为。
(4)若装置③中的试剂为溴的四氯化碳溶液,则所发生的反应类型为________反应。
(5)实验前往往在烧瓶中加入一些碎瓷片,目的是:__________________________。
实验室用固体NaOH配制0.5 mol/L的NaOH溶液500 mL,有以下仪器和用品有:①烧杯 ②100 mL量筒 ③容量瓶 ④药匙 ⑤玻璃棒 ⑥托盘天平(带砝码)
(1)配制时,没有使用的仪器和用品有____________(填序号),还缺少的仪器是。
(2)在配制的转移过程中某学生进行如右图操作,请指出其中的错误:、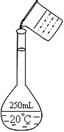
(3)下列操作会使配制的溶液浓度偏低的是(填字母)
A. 没有将洗涤液转移到容量瓶B.转移过程中有少量溶液溅出
C. 容量瓶洗净后未干燥 D.定容时俯视刻度线
(4)在容量瓶使用方法中,下列操作不正确的是(填序号)
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用碱液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
D.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
(5) 实验中还需要2mol/L的NaOH溶液950mL,配制时应选用的容量瓶的规格和称取NaOH的质量分别是(填序号)
A.1000mL,80gB.950mL,76g
C.任意规格,72gD.500mL,42g